RESUMO
Esse estudo busca amostrar a diversidade de briófitas (bryophyta/musgos e marchantiophyta/hepáticas), bem como conhecer o padrão de distribuição geográfica brasileira e os domínios fitogeográficos, além de registrar o tipo de colonização nos substratos (grupos briocenológicos) e os hábitos de vida das espécies ocorrentes no Parque Estadual Cânion do Rio Poti, Buriti dos Montes/Piauí. Para tanto, o material botânico foi coletado, herborizado e identificado seguindo a metodologia usual, especializada, provenientes de trechos de áreas de afloramentos rochosos presentes sobre a influência do Cânion do Rio Poti. A flora de briófitas do Parque é composta por 14 espécies, distribuídas em seis famílias e oito gêneros. Destas, 13 são espécies de musgos, distribuídas em cinco famílias e sete gêneros e uma espécie de hepática (uma família e um gênero). Desse total, 12 espécies (85,7%) apresentam-se distribuídas em mais de sete Estados do Brasil e em mais de três domínios fitogeográficos e duas (14,3%) com rara distribuição e também em um único domínio fitogeográfico. Esta pesquisa é a primeira para o Parque, e vem contribuir com informações importantes de registros desse grupo vegetal, em área de afloramentos rochosos do bioma Caatinga, o que amplia sobre a ocorrência e a distribuição geográfica das espécies. Novos estudos florísticos de briófitas são necessários em todos ambientes de delimitação do Parque para amostrar a real diversidade de briófitas.
Palavras-chave: Afloramentos rochosos; Briófitas de Caatinga; Unidade de Conservação
ABSTRACT
This study aims to sample the diversity of bryophytes (bryophyta / mosses and marchantiophyta / livewort), as well as to know their pattern of Brazilian geographic distribution and phytogeographical domains. Also, to record the type of colonization in the substrates and the habitats of species occurring in the State Park of the Poti River in Buriti dos Montes / Piauí. The botanical material was collected, herborized and identified following the usual specialized literature, from stretches of rock outcrops present under the influence of the Poti River Canyon. The bryophyte flora of the Park is composed of 14 species, distributed in six families and eight genera. Among them, 13 are species of mosses, distributed in five families and seven genera, and one species of liverwort (one family and one genus). From this total, 12 species (85.7%) are distributed in more than seven Brazilian states and in more than three phytogeographic domains, and two (14.3%) with rare distribution and in a single phytogeographic domain. This research is the first one for the Park, and comes to contribute with important information and records of this vegetal group in an area of rocky outcrops of the Caatinga biome, which amplifies the occurrence and the geographical distribution of the species. New floristic studies of bryophytes are necessary in all Park boundary environments to sample the real diversity of bryophytes.
Keywords: Rock outcrops; Bryophytes of Caatinga; Conservation Unit
1 INTRODUÇÃO
As briófitas são plantas avasculares terrestres, pequenas e de estrutura relativamente simples, sendo as primeiras a colonizarem o ambiente terrestre (BORDIN, 2008; BUCK; GOFFINET, 2009; SILVA; SILVA; PORTO, 2014). Crescem e habitam sobre uma larga variedade de substratos, como solo arenoso e argiloso, tronco vivo ou em decomposição, superfícies de rocha, folhas vivas e substratos artificiais, entre outros (PORTO, 2014). Representam o segundo maior grupo de plantas terrestres, com cerca de 17.800 espécies para o mundo, atrás das angiospermas (GOFFINET et al., 2009), apresentando ampla distribuição geográfica nos biomas terrestres (LEMOS-MICHEL, 2001; PERALTA, 2005).
Esse grupo/taxon encontram-se classificado em três divisões que as diferenciam, quanto a estrutura taxonômica e seu habitat ecológico, sendo estas: Anthocerophyta (antóceros), Bryophyta (musgos) e as (hepáticas) ou Marchantiophyta (CRANDALL-STOTLER et al., 2009; SHAW; GOFFINET, 2009).
No Brasil, atualmente devido aos recentes avanços e atualizações nas classificações dos grupos/taxa de briófitas, a diversidade de espécies, segundo dados online da Lista Brasileira de Briófitas é composta por 1.610 espécies (898 musgos, 694 hepáticas e 18 antóceros), distribuídas em 117 famílias e 419 gêneros, das quais 357 (21,6%) são endêmicas do Brasil (LEFB, 2021). Em termos de número de espécies de briófitas, o Nordeste brasileiro é considerado a terceira região mais rica do país (ABREU e OLIVEIRA, 2019). Para essa região são conhecidas 745 espécies (370 hepáticas, 357 musgos e 8 antóceros), distribuídas em 226 gêneros e 78 famílias e o estado do Piauí possuí registradas 50 espécies (40 musgos, 9 hepáticas e um antócero), distribuídas 28 gêneros e 22 famílias (LEFB, 2021).
É de conhecimento que as briófitas são componentes importantes em diversos tipos de ecossistemas, em locais como afloramentos rochosos ou inselbergs conhecidos, por exemplo, como habitats com restrições severas de água, algumas espécies apresentam sucesso na capacidade de colonizar, crescer e reproduzir (PÔRTO et al., 2016; PENALOZA-BOJACÁ et al., 2017a).
Os afloramentos rochosos são considerados hotspots de biodiversidade de importância global (PENALOZA-BOJACÁ et al., 2017a), conhecidos como ecossistemas isolados inseridos na paisagem adjacente, geralmente esses são elevações monolíticas ou agrupadas que aparecem isoladas na paisagem circundante (SILVA, 2016). Esses habitats são ambientes caracterizados por condições ambientais adversas, com altas variações em temperaturas diárias, elevada exposição aos raios UV, solos impermeáveis com baixa capacidades de retenção e em alguns casos altos níveis de minerais (POREMBSKI; BARTHLOTT, 2000; PENALOZA-BOJACÁ et al., 2017). Apresentam ainda, uma grande amplitude térmica diária, relativa ao intenso aquecimento da rocha durante o dia e seu resfriamento noturno (VINCENT et al., 2002). Nesse ambiente inóspito, há uma flora diversificada com comunidades de plantas de vários grupos endêmicos ou raros, geograficamente disjuntos e ameaçados, e fontes de descoberta de novas espécies, incluindo aquelas adaptadas à dessecação, em especial as briófitas, um grupo muito pouco estudado neste tipo de ambiente (SILVA et al., 2014a; SILVA, 2016; SILVA; PÔRTO, 2016; PENALOZA-BOJACÁ et al., 2017).
Nesses ambientes de condições estressantes, particularmente em afloramentos rochosos e fendas nas rochas, as briófitas são colonizadoras comuns e primárias, pois estão adaptadas a altos níveis de insolação e temperatura (condições climáticas), disponibilidade reduzida de água e a solos rasos e oligotróficos (FRAHM, 1991; POREMBSKI, 2007; SILVA et al., 2014a; SILVA et al., 2014b; SILVA; SILVA; PÔRTO, 2016; PENALOZA-BOJACÁ et al., 2017). Apresentam ainda adaptações como mecanismos de sobrevivência e reprodução, como algumas estratégias de tolerância à dessecação durante os períodos de seca e, por serem poiquiloídricas são capazes de ganhar e perder água rapidamente, oscilando seu conteúdo hídrico de acordo com a disponibilidade de água no ambiente (FRAHM, 1991; PROCTOR et al., 2007).
Nesse contexto, no Brasil nas últimas décadas vem aumentando o número de estudos sobre levantamentos florísticos de briófitas crescendo em afloramentos. Para o Bioma Caatinga existe os estudos de (BASTOS et al.,1998; BASTOS et al., 2000; VALENTE; PÔRTO, 2006; SILVA; GERMANO, 2013; SILVA; MELO, 2013; SILVA et al., 2014a; SILVA et al., 2014b; SILVA et al., 2014c; SILVA; PÔRTO, 2016; VIANA et al., 2016; FANTACELLE et al., 2017; PENALOZA-BOJACÁ et al., 2017; SILVA et al., 2017a; SILVA et al., 2017b). No domínio fitogeográfico da Mata Atlântica, destacam-se (COSTA, 1994; VALENTE et al., 2006; VALENTE et al., 2013). Outros estudos foram também desenvolvidos em outros domínios fitogeográficos do Brasil, havendo ainda a necessidade de novas pesquisas em áreas ainda inexploradas para o grupo.
Nesse tipo de ambiente a riqueza e diversidade de espécies no Brasil não era muito elevada ou conhecida estando entre 4 a 29 (SILVA et al., 2014a). Atualmente, são conhecidos para o Brasil 108 espécies de briófitas, distribuídas em 26 famílias, 54 gêneros, sendo 66 musgos e 42 hepáticas (PENALOZA-BOJACÁ et al., 2017b). Necessitando-se de pesquisas adicionais para compreender como as briófitas ocupam afloramentos de rochas e seus numerosos micro-habitats (VIANA et al., 2016; FANTACELLE et al., 2017; PEÑALOZA-BOJACÁ et al., 2017; PENALOZA-BOJACÁ et al., 2017a; PENALOZA-BOJACÁ et al., 2017b; SILVA et al., 2018a; SILVA et al., 2018b).
Além desse tipo de estudo de briófitas em afloramentos rochoso, outros ainda, constituem-se, temas bastante promissores para pesquisa e precisam de maiores investigações, como os relacionados aos aspectos sobre a biologia e estratégias reprodutivas deste tipo de micro-habitat (PÔRTO et al., 2016), bem como os relacionados às características físico-químicas (SILVA et al., 2018b), aos parâmetros populacionais e de comunidades das briófitas (SILVA et al., 2014a).
No Nordeste brasileiro, o número de publicações e estudos científicos sobre as briófitas, vem crescendo gradualmente nos últimos anos (ABREU, OLIVEIRA, 2019). O Piauí, vem acompanhando esse aumento, antes existia apenas o levantamento de musgos do Parque Nacional de Sete Cidades (CASTRO et al., 2002). Hoje, no estado existem alguns inventários brioflorísticos com lista de espécies ocorrentes em Unidades de Conservação e em áreas especificas de alguns munícipios, como na Cachoeira do bota-fora em Piripiri (SOUSA et al., 2019a,b), Parque Nacional da Serra da Capivara (NASCIMENTO et al., 2019), Parque Nacional de Sete Cidade (NASCIMENTO et al., 2020), Bosque Sagrado da Guarita em Bom Princípio do Piauí (Santos et al., 2021). Adicionalmente, há também para o estado um estudo de checklist de briófitas ocorrentes em diferentes regiões da Caatinga, Cerrado e áreas transicionais na Ecorregião do Complexo de Campo Maior (SILVA et al., 2019). Em geral, esses estudos contendo lista de espécies, em alguns casos referindo-se a novas ocorrências para o nordeste e para o estado, contribuem pra ampliar o conhecimento da distribuição geográfica das briófitas.
Vale ainda destacar, que outras pesquisas com briófitas estão sendo realizadas no estado, principalmente, pelo grupo de pesquisa em Biodiversidade vegetal, ligado ao laboratório de Criptógamas, da Universidade Estadual do Piauí (UESPI), Campus Heróis do Jenipapo, localizado no município de Campo Maior, Piauí (SILVA et al., 2019; NASCIMENTO et al., 2020).
Assim, considerando o pouco número de trabalhos sobre briófitas no Piauí e a significativa diversidade vegetal já comprovada, esses dados demostram notoriedade sobre a necessidade de continuação dos estudos sobre o grupo no Piauí. Pelo exposto, de acordo com as bibliografias consultadas, são poucos os estudos sobre a biodiversidade de briófitas presentes em afloramentos rochosos no Brasil, em especial no bioma Caatinga, demostrando que nessas áreas são escassos de conhecimento. Notoriamente, esta pesquisa é o primeiro estudo sobre as briófitas crescendo em afloramentos rochosos no estado da Piauí. Isso corrobora com o que afirma Silva (2016), sobre a necessidade do aumento do número de estudos nesses ambientes, buscando-se a elaboração de políticas públicas de manejo para o ecossistema, fornecendo subsídios para conservação das suas espécies.
Nesse contexto, objetivou-se com esse estudo amostrar a diversidade de briófitas (musgos/bryophyta e hepáticas/marchantiophyta) e reconhecer os hábitos de vida das espécies ocorrentes no Parque Estadual Cânion do Rio Poti, Buriti dos Montes, bem como conhecer o padrão de distribuição geográfica brasileira e os domínios fitogeográficos, além de registrar o tipo de colonização nos substratos (grupos briocenológicos).
2 MATERIAL E MÉTODOS
2.1 Área de estudo
O município de Buriti dos Montes, Estado do Piauí, compreende 2.437,326 km², possui população estimada de 8.264 habitantes e densidade demográfica de 3,01 hab/km² (IBGE, 2021). O município foi criado pela Lei nº. 4.477 de 29/04/1992, está localizado na microrregião Campo Maior, conhecida como Território de Desenvolvimento dos Carnaubais, tendo como limites ao Norte os municípios de Pedro II e Milton Brandão, ao sul São Miguel do Tapuio e Castelo do Piauí, (Figura 1). A sede municipal tem as coordenadas geográficas de 05º18’43” de latitude sul e 41º 05’52” de longitude oeste e dista cerca de 250 km de Teresina (Aguiar, 2004).
O Parque Estadual Cânion do Rio Poti (Figura 1), criado em 18 de outubro de 2017 pelo decreto nº. 17.429, é uma Unidade de Conservação de Proteção Integral, com área de 24.772,23 ha, localizado no município de Buriti dos Montes, Piauí, em um trecho do médio curso da bacia hidrográfica do rio Poti, pertencente a ecorregião do Complexo Ibiapaba – Araripe (Velloso et al., 2002; Moraes et al., 2020; Moraes et al., 2021).
Figura 1 – Localização e limite geográfico do Parque Estadual Cânion do Rio Poti, Buriti dos Montes, Piauí, Brasil.
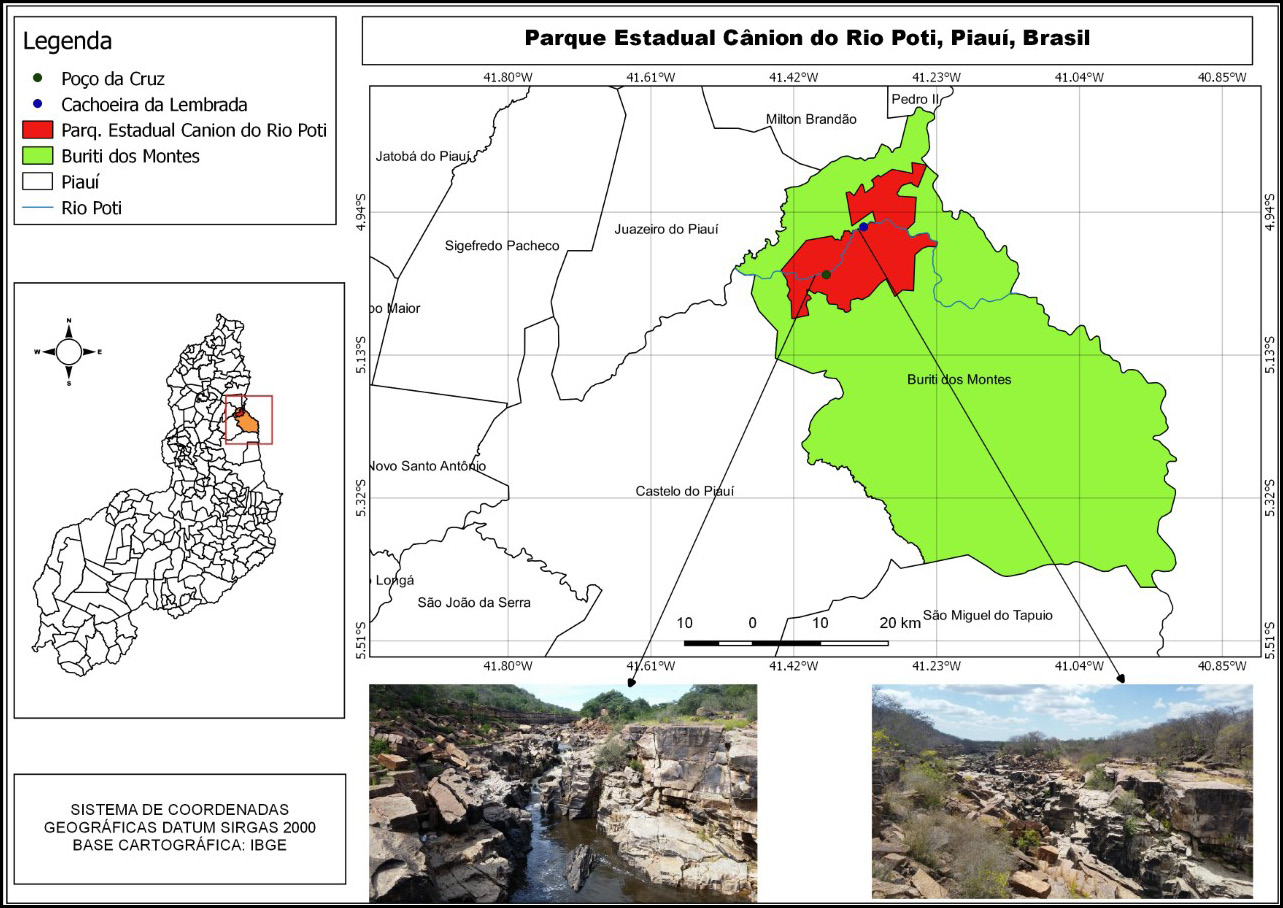
Fonte: IBGE (2021); Google Earth (2020). Organização dos Autores (maio de 2021).
Legenda: Destaque para as áreas de coleta: 1. Cachoeira da Lembrada/Conceição de Marreiros e 2. Poço da Cruz/ Fazenda Enjeitada.
É oportuno enfatizar, que o Parque em destaque, é uma área de relevante interesse ambiental, localizado dentro do domínio fitogeográfico da Caatinga, conhecida como ecorregião semiárida tropical da América do Sul (Moro et al., 2016). A vegetação da UC é um tipo de floresta tropical sazonal, conhecida dentre todos os ecossistemas mundiais como uma das áreas prioritárias e de estratégia global para conservação da biodiversidade de fauna e flora e proteção de espécies raras e endêmicas (Olson e Dinerstein, 2002; Albuquerque et al., 2012).
Além disso, destaca-se ainda, que a região onde está localizado a UC, ocorre no médio curso da bacia hidrográfica do rio Poti, que é um dos grandes afluentes do rio Parnaíba (CEPRO, 1995; GÓES, 1995). Nessa região, o rio adquire a forma de cânion ao adentrar no front da Serra da Ibiapaba. Assim, esse perfil surge da dinâmica como resultado de fatores externos e da erosão dos terrenos sedimentares da Formação Tianguá e parte da Formação Ipu, ambas constituintes do Grupo Serra Grande, chegando a possuir até 360m de altura nas suas vertentes e paredões de até 300m de profundidade na área de contato entre o cristalino e o sedimentar (BARRETO et al., 2012; BARRETO; COSTA, 2014).
Entre outras informações, essa região apresenta uma feição geológica e geomorfológica peculiar, os quais proporcionam um mosaico de ambientes e paisagens como morros, vales, serras e cânions, formados principalmente por meio das estruturas geomorfológicas, edáficas e climáticas presentes na região (Barreto 2011, 2012, 2014; Moro et al., 2016; Santos, 2018; Costa et al., 2020; Silva et al., 2021). Ademais, inclui também diversos recursos naturais e a presença de sítios arqueológicos e paleontológicos de grande valor sociocultural, e histórico ambiental (Moraes et al., 2020; Moraes et al., 2020; Silva et al., 2021).
Dessa forma, a região do Parque Estadual Cânion do Rio Poti, por apresentar diversas feições geomorfológicas de destaque, e uma grande diversidade de vegetação, hidrografia, geomorfologia e solo, fatores estes, que torna o Parque um lugar com características ambientais bastante distintas, com umidade adequada em alguns locais para o desenvolvimento de várias espécies de plantas (MORAES et al., 2020). Junto a isso, a vegetação adjacente do trecho do Cânion por onde passa o rio Poti, apresenta-se diferenciada, tanto em tipos de espécies de angiospermas das famílias (Bromeliaceae, Cactaceae, Cyperaceae e Fabaceae, entre outras de importância da Caatinga), algumas espécies de samambaias (MORAES et al., 2021), e uma riqueza singela de espécies de briófitas, ambas sobrevivendo entre e junto aos paredões e afloramentos rochosos, ou associados nas formações de mata ciliar e de vegetação de encosta.
Para essa UC, todos esses condicionantes ambientais, climáticas, geológicos e geomorfológicos supracitados, possibilitam condições geofísicoquímicos e ambientais favoráveis para a presença de uma diversidade biológica representativa da fauna e flora regional, com algumas espécies endêmicas e ameaçadas de extinção. Assim, nessa perspectiva, essas condições proporcionam o crescimento, desenvolvimento e colonização de várias espécies de angiospermas, briófitas e samambaias, incluindo também a presença de uma fauna rica em aves, répteis e mamíferos de grande valor com aspectos característicos peculiares biodiversos (Moraes et al., 2020; Moraes et al., 2021).
Neste estudo, realizou-se o levantamento das briófitas do grupo das Bryophytas (musgos) e Marchantiophytas (hepáticas) ocorrentes em áreas de afloramentos rochosos sobre a influência do Cânion do Rio Poti. As amostras de briófitas foram coletadas em dois trechos no Parque Estadual Cânion do Rio Poti, Buriti dos Montes, Piauí, Brasil (Tabela 1).
Tabela 1 – Dados de localização das áreas de coleta de material botânico, dados climáticos e da vegetação no Parque Estadual Cânion do Rio Poti, Buriti dos Montes, Piauí, Brasil.
|
Área/localidade
|
Município
|
Coordenadas
|
Dados climáticos
|
Vegetação
|
|
Temperaturas médias anuais
|
Precipitação
|
|
Área 1
Cachoeira da lembrada/ Conceição dos Marreiros
|
Buriti dos Montes
|
Lat. 4°57’33.97”S
Log.
41°19’37.10”O
|
Temperaturas mínimas de 22 ºC e máximas de 35 ºC
|
Precipitação média anual entre 800 a 1.600 mm
|
Caatinga
|
|
Área 2 Poço da Cruz/Fazenda Enjeitada
|
Lat 5° 1’23.25”S
Log. 41°22’35.90”O
|
Fonte: Moraes, L.A, julho (2018).
Em relação a fitofisionomia da vegetação dos locais de coleta, nas duas áreas de coletas, onde foram encontradas as briófitas (trecho do cânion do Rio Poti, entre a cachoeira da lembrada/Conceição dos Marreiros e o Poço da cruz/fazenda enjeitada), foi possível perceber que a vegetação presente apresenta fisionomias semelhantes (estrutura vegetacional) e em bom estado de conservação. Essa estrutura vegetacional em ambas as áreas, sofre influência da precipitação das águas do rio e encontra-se dispostas sobre os afloramentos rochosos superficiais (folhelhos aflorando em diferentes direções e sentidos na superfície) e os solos apresentam pouca profundidade, uma textura de cascalho com aspectos pedregoso e rochoso de diferentes tamanhos e formas, baixa fertilidade natural, elevada acidez.
Na área 1, destaca-se uma vegetação mais aberta com algumas plantas de pequeno porte, dando um aspecto de formações baixas como as herbáceas, subarbustos e arbustos (Figura 2A e 2B). Já na área 2, além de áreas com vegetação com formações baixas e abertas (herbáceas, subarbustos), há também a presença de arbustos e árvores, dando em alguns trechos uma formação mais alta e fechada (Figura 2C e 2D).
Figura 2 – Figura 2. Visão geral da área de coleta de briófitas no Parque Estadual Cânion do Rio Poti onde foram coletadas as briófitas.

Fonte: Acervo particular do autor (dezembro de 2018).
Legenda: A e B: Cachoeira da Lembrada/Conceição dos Marreiros; C e D: Poço da Cruz/Fazenda Enjeitada.
Portanto, para essa UC, os diversos condicionantes das paisagens naturais formados por meio dos aspectos geofísicoquímicos e ambientais da região (Barreto e Costa, 2014; Costa et al., 2020) são intrinsecamente responsáveis pela beleza cênica única do local com vegetação de Caatinga rica em espécies de angiospermas, briófitas e samambaias, algumas endêmicas, incluindo também uma biodiversidade rica da fauna de aves, répteis e mamíferos (Decreto n. 17.429, 2017; MORAES et al., 2020; MORAES et al., 2021).
2.2 Coleta, Herborização, Identificação das espécies, Características Ecológicas e Biogeográfica
Para a realização do estudo florístico das briófitas do Parque Cânion do Rio Poti foram realizadas expedições trimestrais ao campo, com duração média de três dias, percorrendo diferentes áreas do trecho do médio curso do Rio Poti no Município de Buriti dos Montes, Piauí, no período de setembro de 2017 a setembro de 2018, abrangendo as estações chuvosa e seca. Foram coletadas amostras de material botânico em estágio reprodutivo, atendendo ao critério de inclusão que foram observadas em caminhadas assistemáticas em toda a extensão da área de estudo. A pesquisa foi cadastrada no Sistema Nacional de Gestão do Patrimônio Genético e do Conhecimento Tradicional Associado (SisGen), sobre o número AD49249. Vale frisar que todos os procedimentos de coleta, manejo e preservação do material biológico foram seguidos e mantidos.
As briófitas ocorrentes no Parque foram coletadas segundo as técnicas usuais especializadas, ou seja, o material foi coletado manualmente ou com o auxílio de canivete e armazenados em sacos de papel e devidamente etiquetados (GRADSTEIN et al., 2001; FRAHM, 2003). Posteriormente, esse material foi herborizado e preservado de acordo com as técnicas usuais para briófitas (GRADSTEIN et al., 2001). Durante as coletas foram registrados dados sobre a data e local de coleta, tipo de ecossistema, hábito, forma de crescimento, substrato colonizado e demais observações ecológicas e/ou taxonômicas pertinentes (MORI et al., 1989).
A identificação dos taxa foi realizada no Laboratório de Biologia Vegetal/LABIVE, da Universidade Estadual do Maranhão/UEMA, baseada nos trabalhos de Gradstein et al., (2001), Buck (2003), Buck Goffinet (2009), Goffinet et al. (2009), Bordin e Yano (2013). Além disso, duplicatas foram enviadas a especialistas nos grupos para identificação e/ou confirmação das mesmas. Todos os exemplares foram incorporados ao acervo do Herbário Professor Aluízio Bittencourt (HABIT), do Centro de Estudos Superiores de Caxias/CESC, da Universidade Estadual do Maranhão/UEMA.
Os taxa estão apresentados em ordem alfabética de família, gênero e espécie seguindo o sistema de classificação proposto: para os musgos – Bryophyta por Goffinet et al. (2009) e para hepáticas – Marchantiophyta por Crandall-Stotler et al., (2009).
A grafia dos nomes científicos, sinonímia, autores, distribuição geográfica brasileira e os domínios fitogeográficos das espécies de briófitas seguiu o proposto por Gradstein e Costa (2003), Yano (2008), Forzza et al. (2010), Costa et al. (2011) e Costa e Peralta (2015) e foram confirmadas utilizando os bancos de dados do Nomenclatural Data Base do Missiouri Botanical Garden – Trópicos (www.tropicos.org), The International Plant Names Index (www.ipni.org) e na Lista online de espécies da Flora do Brasil 2020 (LEFB, 2020), disponível em: http://floradobrasil.jbrj.gov.br/reflora/floradobrasil/ e acesso em: 20/05/2021. As espécies após receberem esse padrão de distribuição geográfica brasileira foram classificadas em categorias\padrão, seguindo o proposto por Valente e Pôrto (2006), que consideram “amplo” aqueles ocorrendo em dez ou mais estados brasileiros; “moderado” aqueles que ocorrem em cinco a nove estados; e como “raras” aquelas briófitas que ocorrem em um a quatro estados brasileiros. As novas ocorrências para o Piauí foram destacadas com um asterisco (*).
Quanto os aspectos ecológicos, as espécies de briófitas do Parque foram ainda classificadas de acordo com os grupos briocenológicos e substratos colonizados em: corticícolos (tronco vivo), epíxilo (tronco morto), rupícolo (rocha) e terrícolo - solos (FUDALI, 2001). Para a classificação quanto à forma de crescimento em acrocárpicos, pleurocárpicos e cladocárpicos, usou-se a bibliografia especializada de La-Farge England (1996).
As espécies de briófitas identificadas foram ainda classificadas de acordo com a categoria de ameaça e extinção da IUCN, conhecido como estado de conservação das espécies, ou seja, em: Não avaliada (NE), Dados insuficientes (DD), Pouco preocupante (LC), Quase ameaçada Vulnerável (NT), Vulnerável (VU), Em perigo (EN), Criticamente em perigo (CR) e Extinta na natureza (EX). Essas informações foram obtidas da Lista vermelha da IUCN de espécies ameaçadas (Briófitas Ameaçadas no Brasil), disponível em: http://oldredlist.iucnredlist.org/, e da Lista online de espécies da Flora do Brasil 2020 (LEFB, 2020).
Realizou-se ainda, uma simples comparação florística, por meio de uma matriz de presença e ausência, dos táxons de briófitas encontrados no Parque Estadual Cânion do Rio Poti, com outras dez listas florísticas publicadas em áreas com vegetação do domínio fitogeográfico Caatinga. Para essa comparação, utilizou-se Pôrto et al. (1994); Pôrto e Bezerra (1996); Bastos et al. (1998); Bastos et al. (2000); Castro et al. (2002); Silva e Germano (2013); Silva et al. (2014a); Silva et al. (2014b); Silva et al. (2017a) e Batista et al. (2018).
3. RESULTADOS E DISCUSSÃO
A flora de briófitas do Parque Estadual Cânion do Rio Poti, é composta por 14 espécies, distribuídas em sete famílias e oito gêneros. Destas, 13 são espécies de musgos, distribuídas em cinco famílias e sete gêneros e uma espécie de hepática, distribuída em uma família e um gênero, como consta na tabela 2.
Tabela 2 - Lista de espécies de briófitas do Parque Estadual Cânion do Rio Poti por Taxa/família, espécie e posição do periquécio; Forma de Vida (FV); Substrato de Colonização (SC); Distribuição Geográfica no Brasil (DGB); Padrão de Distribuição no Brasil (PDB); Domínios Fitogeográficos (DF); Endemismo (END) e Estado de Conservação (EC).
|
TAXA
|
FV -SC-PP
|
DGB e
DB
|
DF
|
END
|
EC
|
Nº do Voucher
|
|
BRYOPHYTA (Musgos)
|
|
|
|
|
|
|
|
|
BARTRAMIACEAE Schägr.
|
|
|
|
|
|
|
|
|
1. Philonotis cernua (Wilson) Griffin & W.R.Buck, 1989.
Acrocárpico
|
TF/R
|
CE, DF, ES, GO, MA, MG, MT, PB, PE, RJ, PR, RS, SC, SE, SP
(Ampla)
|
CA, CE, MA
|
Não
|
NE
|
MORAES, 10
|
|
2. Philonotis uncinata (Schwägr.) Brid., 1827.
Acrocárpico
|
TF/R
|
AC, AM, AP, BA, CE, DF, ES, GO, MS, MG, MT, PA, PB, PE, PI, PR, RJ, RO, RS, SC, SP, TO
(Ampla)
|
AM,
CA, CE, MA, PA, PP
|
Não
|
NE
|
MORAES, 65
|
|
BRYACEAE Schwägr.
|
|
|
|
|
|
|
|
3. Bryum cellulare Hook. ex Schwägr.
, 2006.
Acrocárpico
|
TF/T
|
CE, MG, RS
(rara)
|
MA
|
Não
|
NE
|
MORAES, 69
|
|
DICRANACEAE Schimp.
|
|
|
|
|
|
|
|
|
4. Campylopus fragilis (Brid.) Bruch & Schimp. 1847.
Acrocárpico
|
TF/T
|
MG, RJ
(Rara)
|
MA
|
Não
|
NE
|
MORAES, 11
|
|
5. Campylopus savannarum (Müll. Hal.) Mitt., 1869.
Acrocárpico
|
TF/R
|
AM, BA, CE, ES, GO, MA, MG, MS, MT, PA, PR, PE, PI, RJ, RO, RR, SE, SP, TO
(Ampla)
|
AM, CA, CE, MA, PA
|
Não
|
NE
|
MORAES, 18
|
|
6. Dicranella hilariana (Mont.) Mitt. 1869.
Acrocárpico
|
TF/T
|
AC, MG, MS, MT, PA, RJ, RO, SP
(Ampla)
|
AM,
CE, MA
|
Não
|
NE
|
MORAES, 19
|
|
FISSIDENTACEAE Schimp.
|
|
|
|
|
|
|
|
|
7. Fissidens intromarginatus (Hampe) Mitt., 1869.
Acrocárpico
|
FL/R
|
AC, BA, CE, DF, ES, GO, MG, MS, MT, PA, PR, RJ, RS, SP
(Ampla)
|
AM, CA, CE, MA, PA
|
Não
|
NE
|
MORAES, 66
|
|
8. Fissidens leptophyllus Mont., 1840.
Acrocárpico
|
FL/T
|
AC, AM, BA, GO, MA, MT, SP
(Moderado)
|
AM, CE, MA, PA
|
Não
|
NE
|
MORAES, 73
|
|
9. Fissidens pellucidus Hornsch., 1841.
Acrocárpico
|
FL/T
|
AC, AM, BA, CE, DF, ES, GO, MG, MT, PA, PB, PE, PR, RJ, RO, RR, RS, SC, SP, TO
(Ampla)
|
AM, CA, CE, MA, PA,
PP
|
Não
|
NE
|
MORAES, 20
|
|
10. Fissidens submarginatus Bruch. 1840.
Acrocárpico
|
FL/T
|
AC, AM, BA, CE, DF, ES, GO, MA, MG, MT, PA, PB, PE, PI, RJ, RN, RO, RS, SP, SC
(Ampla)
|
AM, CA, CE, MA,
PA, PP
|
Não
|
NE
|
MORAES, 24
|
|
11. Fissidens zollingeri Mont., 1845.
Acrocárpico
|
FL/R
|
AC, AL, AM, BA, CE, DF, ES, GO, MA, MG, MS, MT,
PA, PB, PE, RJ, RO, RR, RS, PR, SC, SE, SP, TO
(Ampla)
|
AM, CA, CE, MA,
PA
|
Não
|
NE
|
MORAES, 66
|
|
MARCHANTIOPHYTA (Hepáticas)
|
|
SPLACHNOBRYACEAE A.K.Kop.
|
|
|
12. Splachnobryum obtusum Brid.) Müll. Hal., 1869.
Acrocárpico
|
TF/R
|
AC, AL, AM, AP, CE, GO, MS, RS, SP
(Moderado)
|
AM,
CE, MA, PA
|
Não
|
NE
|
MORAES, 25
|
|
STEREOPHILACEAE W. R. Buck & Ireland
|
|
|
13. Entodontopsis leucostega (Brid.) W.R.Buck & Ireland, 1985.
Pleurocárpico
|
TM/R
|
AC, AM, PA, RO, RR, TO, BA, CE, MA, PB, PE, PI, DF, GO, MS, MT, MG, RJ, SP
(Ampla)
|
AM, CA, CE, MA,
PA
|
Não
|
NE
|
MORAES, 29
|
|
FOSSOMBRONIACEAE Harsl.
|
|
|
14. Fossombronia porphyrorhiza
(Nees) Prosk., 1955.
Sem classificação
|
FO/R
|
TO, BA, CE, DF, ES, GO, MA, MG, MS, MT, PE, PI, PR, RJ, RS, SP
(Ampla)
|
CA, CE, MA, PA
|
Não
|
NE
|
MORAES, 79
|
Fonte. Dados do autor com consulta na Lista online de espécies da Flora do Brasil 2020 (2021), disponível em: http://floradobrasil.jbrj.gov.br/reflora/floradobrasil/. Acesso em: 26.05.21.
Legenda: Posição do periquécio: Acrocárpico, pleurocárpico e sem classificação. Forma de vida (FV): Folhosa - FO, Flabelado - FL, Trama - TM, Tufo - TF. Substrato de colonização (SC): C - corticícolos; EX - epíxilo; R - rupícolo; EF - epifilo; T - terrícolo; CM - casmófito. Distribuição no Brasil (siglas designativas das Unidades da Federação): AC – Acre; AL – Alagoas; AM – Amazonas; AP – Amapá; BA – Bahia; CE – Ceará; DF – Federal District of Brasília; ES – Espírito Santo; GO – Goiás; MA – Maranhão; MS – Mato Grosso do Sul; MT – Mato Grosso; MG – Minas Gerais; PA – Pará; PB – Paraíba; PE – Pernambuco; PI – Piauí; PR – Paraná; RJ – Rio de Janeiro; RN – Rio Grande do Norte; RO – Rondônia; RR – Roraima; RS – Rio Grande do Sul; SC – Santa Catarina; SE – Sergipe; SP – São Paulo; TO – Tocantins. Padrão de distribuição no Brasil: “amplo” ocorrência em dez ou mais estados brasileiros; “moderado” ocorrência em cinco a nove estados; e “raras” ou “restritas” ocorrência em um a quatro estados brasileiros. Domínio fitogeográfico (AM = Amazônia; CA = Caatinga; CE = Cerrado; MA = Mata Atlântica; PA = Pantanal; PP = Pampa). Endêmica do Brasil: Sim, Não. Estado de Conservação segundo a IUCN: NE – Não avaliada; DD – dados insuficientes; LC – pouco preucupante; NT – quase ameaçada; VU – vulnerável; EM – ameaçada de extinção; CR – criticamente ameaçada; EW – extinta na natureza; EX – extinta.
Dos 14 táxons registrados na área estudada, 11 deles foram comuns a outros inventários florísticos no Estado do Piauí: 10 espécies comuns com o Parque Nacional de Sete Cidades (NASCIMENTO et al., 2020), nove espécies com o Parque Nacional da Serra da Capivara (NASCIMENTO et al., 2019), oito com a Ecorregião do Complexo de Campo Maior (SILVA et al., 2019), cinco com a “Cachoeira do bota-fora” (SOUSA et al., 2019a,b), cinco com o Parque Ecológico “Cachoeira do Urubu” (ARAÚJO et al., 2019) e dois com o Bosque Sagrado da Guarita em Bom Princípio do Piauí (SANTOS et al., 2021), exceção feita para as novas ocorrências aqui registradas.
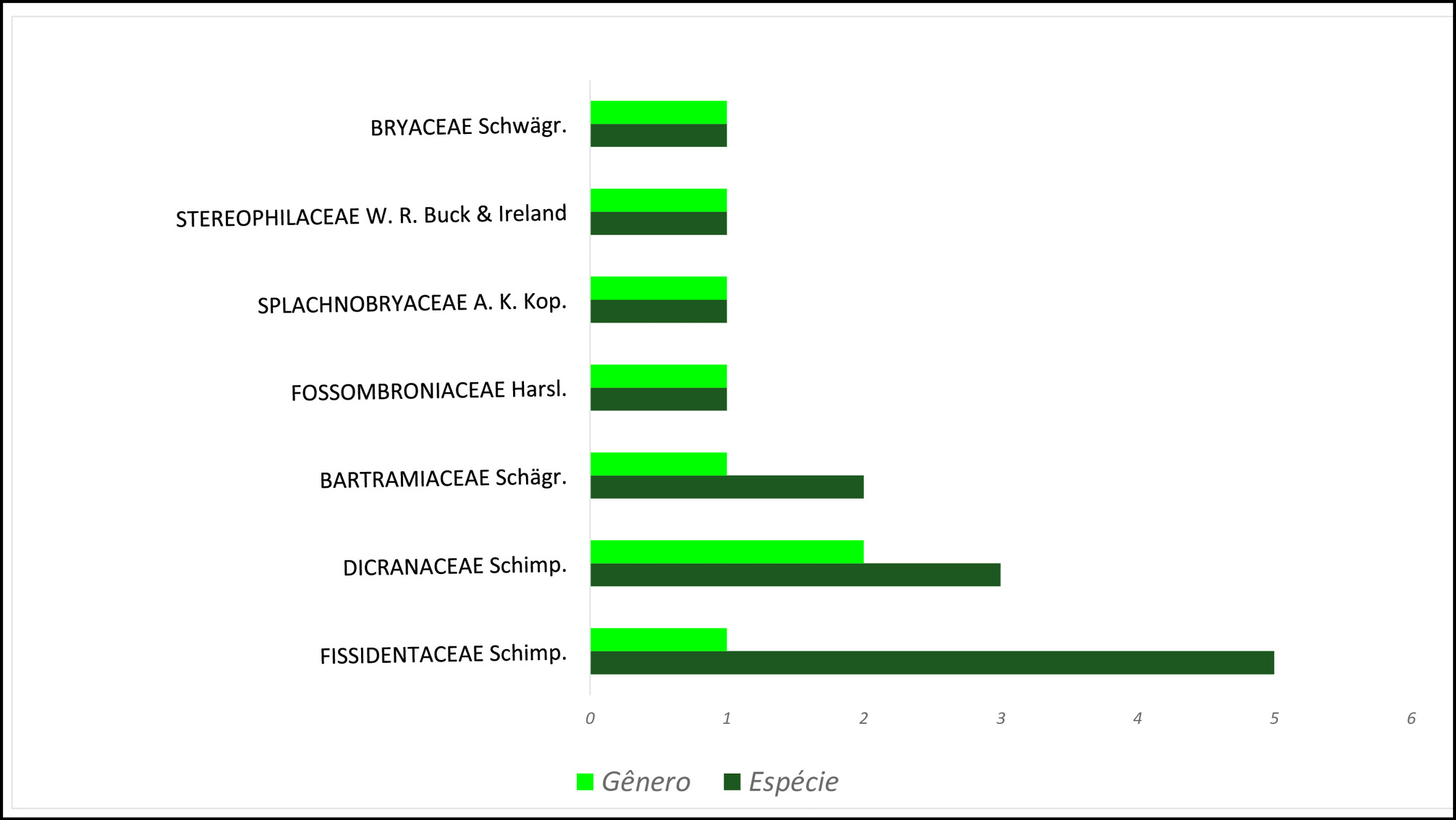
A família mais representativa no Parque Estadual Cânion do Rio Poti foi Fissidentaceae, com cinco espécies (35,8%), seguida de Bartramiaceae e Dicranaceae, com duas espécies (14,3%; 14,3%) e com uma espécie Bryaceae, Fossombroniaceae, Splachnobryaceae e Stereophilaceae (7.1%; 7.1%; 7.1% e 7.1%), respectivamente (Figura 3).
Figura 3 - Riqueza de espécies e gêneros representada por famílias de briófitas (hepáticas e musgos) ocorrentes no Parque Estadual Cânion do rio Poti, Buriti dos Montes, Piauí.
Fonte: elaborado pelo autor (Junho de 2021).
Fissidentaceae é a família com o maior número de espécies identificadas nesse estudo (5 spp.). Segundo Costa e Luize-Ponzo (2010) e Bordin (2011) está pertence a classe Bryopsida, ordem Dicranales, uma das maiores e mais representativas famílias de musgos, amplamente distribuída pelo mundo, predominante em regiões tropicais e subtropicais. Além disso, no Brasil, está presente em todas as regiões e em todos os biomas, apresentando uma grande amplitude ecológica, com a maioria dos táxons ocorrendo em áreas preservadas ou degradadas, crescendo como terrícola, rupícola, corticícola, casmofita e epixílica (BORDIN, 2011). Isso pode ser um fator importante para possibilitar um maior aumento de registros dessa família em levantamentos florísticos, o que pode ser uma explicação para a família Fissidentaceae ser bem representada nesse estudo.
Isso se confirma em vários levantamentos florísticos realizados no Brasil, como o de Bastos et al. (1998); Castro et al. (2002); Oliveira; Alves (2006). Brito e Ilkiu-Borges (2013), em Marajó- PA, estudando a brioflora em uma cachoeira na ilha do Arari amostrou sete espécies de Fissidens. Dessas, quatro são similares a este estudo, são elas a F. intromarginatus, F. pellucidus, F. submarginatus e F. zollingeri.
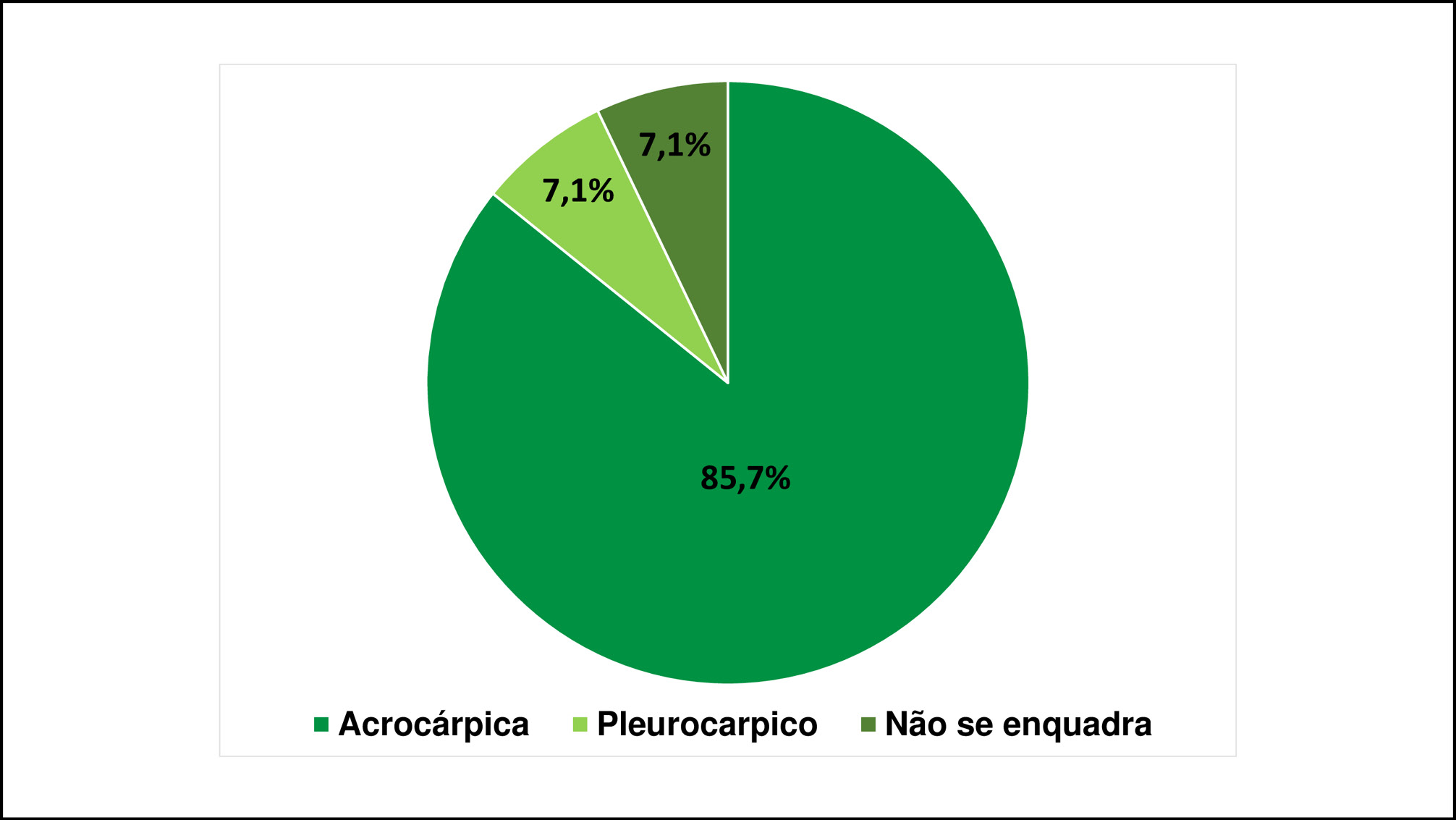
Outro dado levantado é em relação à classificação com base na posição do periquécio, das 14 espécies encontradas, 13 spp. de musgos se enquadram nessa categoria e uma não é classificado pela posição do periquécio como a F. porphyrorhiza (hepática), representando 7,1%. Das que se enquadram, 85,7% (12 spp.) são acrocárpicas e 7,1% (1 spp.) é pleurocárpica (FIGURA 4).
Figura 4 - Classificação das briófitas encontrados no Parque Estadual Cânion do Rio Poti, Piauí, Brasil, com base na posição do periquécio.
Fonte. Elaborado pelo autor (junho de 2021).
Atualmente, no Brasil, diversos estudos têm sido demostrados no que diz respeito à forma de crescimento das briófitas, principalmente, com base na classificação dos musgos em acrocárpicos, cladocárpicos e pleurocárpicos (VIANA et al., 2016; FANTACELLE et al., 2017; PEÑALOZA-BOJACÁ et al., 2017; PENALOZA-BOJACÁ et al., 2017a; PENALOZA-BOJACÁ et al., 2017b). Em área de Caatinga, Ballejos e Bastos (2009), registraram no Parque Estadual das Sete Passagens, no estado da Bahia, a ocorrência de 31 espécies de musgos pleurocárpicos, distribuídas em 22 gêneros e 12 famílias. Estudos realizados em áreas de afloramentos rochosos, por Silva et al. (2014a), Silva et al. (2014b) e Silva e Germano (2013) comprovam que à dominância de musgos acrocárpicos é um padrão na composição brioflorística para essas áreas.
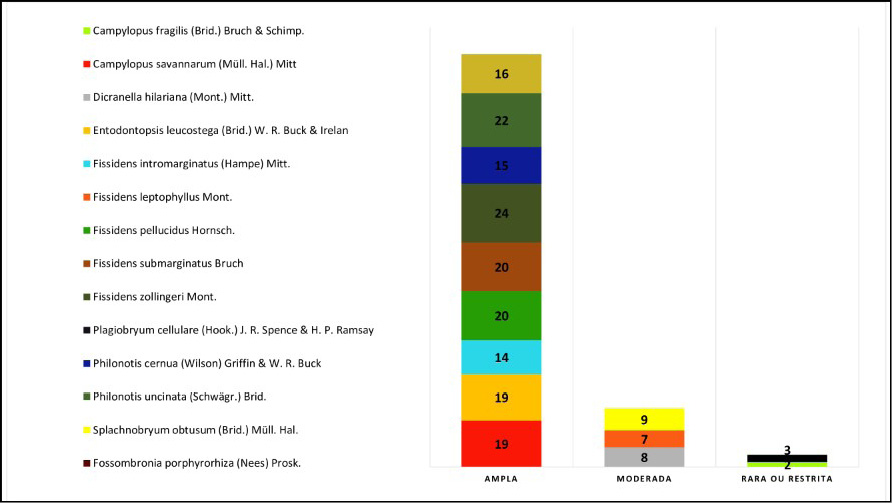
Quanto a distribuição das espécies nos Estados brasileiros, das 14 espécies amostradas na área do Parque, nove apresentaram uma ampla distribuição geográfica brasileira, representando 64,3% do total de briófitas, ou seja, ocorriam de dez ou mais estados brasileiros, sendo elas: C. savannarum, E. leucostega, F. intromarginatus, F. pellucidus, F. porphyrorhiza, F submarginatus, F. zollingeri, P. cernua e P. uncinata. Três espécies apresentaram uma moderada distribuição geográfica brasileira, o que representa 14,3% do total, sendo elas: D. hilariana, F. leptophyllus Mont. e S. obtusum, enquanto para uma rara ou restrita distribuição, apenas duas espécies (14,3%), a B. cellulare e C. fragilis (FIGURA 5).
Figura 5 – Padrão de distribuição geográfica (ampla, moderada, rara ou restrita) segundo Valente e Porte (2006) e número de ocorrência nos Estados brasileiros das espécies de briófitas (hepáticas e musgos) do Parque Estadual Cânion do Rio Poti, Buriti dos Montes, Piauí.
Fonte: elaborado pelo autor (junho de 2021).
Em relação a distribuição das espécies nos domínios fitogeográficos, F. pellucidus, F. submarginatus e P. uncinata, estão presentes em todos os seis domínios fitogeográficos (AM, CA, CE, MA, PA e PP), o que representa 21,4% do total. Em cinco domínios Fitogeográficos (AM, CA, CE, MA e PA) são citadas quatro espécies (28,6%): C. savannarum, E. leucostega, F. intromarginatus e F. zollingeri. Três espécies (21,4%) apresentam distribuição em quatro domínios, sendo elas: F. leptophyllus e S. obtusum (AM, CE, MA e PA) e F. porphyrorhiza (CA, CE, MA e PA). Distribuída em três domínios (14,3%), ocorrem as espécies D. hilariana (AM, CE e MA) e P. cernua (CA, CE e MA). As espécies B. cellulare e C. fragilis apresentam-se distribuídas apenas na Mata atlântica, correspondendo a 14,3% (Tabela 3). Isso denota que essas espécies se encontram bem distribuídas em vários domínios fitogeográficos estados brasileiros.
Tabela 3 - Ocorrência das espécies de briófitas do Parque Estadual Cânion do Rio Poti, Buriti dos Montes – PI, nos domínios fitogeográficos brasileiros (AM = Amazônia; CA = Caatinga; CE = Cerrado; MA = Mata Atlântica; PA = Pantanal e PP = Pampa).
|
Número Domínios Fitogeográficos
|
Domínios Fitogeográficos
|
Espécies
|
|
6
|
AM, CA, CE, MA, PA, PP
|
F. pellucidus, F. submarginatus,
P. uncinata
|
|
5
|
AM, CA, CE, MA, PA
|
C. savannarum, E. leucostega,
F. intromarginatus e F. zollingeri
|
|
4
|
AM, CE, MA, PA
|
F. leptophyllus e S. obtusum
|
|
CA, CE, MA, PA
|
F. porphyrorhiza
|
|
3
|
AM, CE, MA
|
D. hilariana
|
|
CA, CE, MA
|
P. cernua
|
|
1
|
MA
|
C. fragilis e P. cellulare
|
Fonte. Dados do autor com consulta na Lista online de espécies da Flora do Brasil 2020 (2018), disponível em: http://floradobrasil.jbrj.gov.br/reflora/floradobrasil/.
As espécies S. obtusum e P. uncinata são consideradas as mais frequentes, encontradas em todas as áreas. Nenhuma das 14 espécies são consideradas como endêmica do Brasil, além disso, todas encontram-se classificadas como espécie não avaliadas quanto ao Estado de Conservação IUCN (IUCN, 2019; 2021 LEFB, 2020).
Das 14 espécies catalogadas, 10 spp. (71,4%) são registros novos para o estado do Piauí, de acordo com a lista online da flora do Brasil (LEFB, 2020), sendo elas: B. cellulare, C. fragilis, D. hilariana, F. intromarginatus, F. leptophyllus, F. pellucidus, submarginatus, F. zollingeri, P. cernua e S. obtusum. Juntos, esses novos registros, configuram, aproximadamente, 20% do total de espécies inventariadas para o Piauí (LEFB, 2020), isso representa um considerável incremento a biodiversidade de briófitas para o estado.
Essas 10 espécies com possível primeira ocorrência para o Estado do Piauí, foram consultadas e conferidas nas listas brioflorísticas disponíveis publicada na literatura, dais quais, sete constatou-se registros: B. cellulare (SILVA et al., 2019; NASCIMENTO et al., 2020), C. fragilis (NASCIMENTO et al., 2019; SILVA et al., 2019; NASCIMENTO et al., 2020; ARAÚJO et al., 2021), F. leptophyllus (NASCIMENTO et al., 2019; NASCIMENTO et al., 2020), F. submarginatus (NASCIMENTO et al., 2019; SILVA et al., 2019; SOUSA et al., 2019a,b; NASCIMENTO et al., 2020; ARAÚJO et al., 2021), F. zollingeri (CASTRO et al., 2002; NASCIMENTO et al., 2019; SILVA et al., 2019; SOUSA et al., 2019a,b; NASCIMENTO et al., 2020; SANTOS et al., 2021), P. cernua (NASCIMENTO et al., 2019; SILVA et al., 2019; SOUSA et al., 2019a,b; NASCIMENTO et al., 2020; ARAÚJO et al., 2021) e S. obtusum (NASCIMENTO et al., 2019).
Já nas consultas nos herbários virtuais cadastrados no SpeciesLink (2021), constatou-se que apenas as espécies F. submarginatus e F. zollingeri possuem registros de ocorrência para o estado do Piauí, com cinco e três, respectivamente. Portanto, nesse estudo a espécie F. submarginatus é considerada o sexto registro para o Estado, já a espécie F. zollingeri configura-se como o quarto registro.
Nesse estudo é importante destacar que as espécies D. hilariana (Dicranaceae), F. intromarginatus e F. pellucidus (Fissidentacaeae) são as únicas que não possuem registros de ocorrência para o estado do Piauí.
Em relação as espécies registradas nesse estudo, vale destacar, informações básicas sobre as famílias e os gêneros, como segue exposto descrito abaixo.
O gênero Campylopus (32 spp.) pertence à família Dricanaceae e de acordo com Costa e Luize-Ponzo (2010), apresenta-se como o segundo mais diverso no Brasil. São conhecidos para o Brasil 32 espécies, destas 19 ocorrem no nordeste e sete para o estado do Piauí (LEFB, 2020). Nesse estudo, é representado por C. fragilis e C. savannarum.
Campylopus fragilis apresenta uma rara distribuição nos estados brasileiros. A espécie é endêmica do Brasil com pequena abrangência de distribuição nos Estados das regiões Sul e Sudeste do país (INACIO-SILVA et al., 2017). C. fragilis era citada apenas em áreas de Mata Atlântica nos estados de Minas Gerais, Rio de Janeiro, Santa Catarina, São Paulo, configurando-se em 2017 como nova ocorrência para o Rio Grande do Sul, registrada na restinga de Imbé, encontrada próxima à trilha, mata aberta, sobre solo (YANO; BORDIN, 2017). Portanto, esse registro não era esperado no Parque, tendo em vista sua ocorrência restrita ao domínio fitogeográfico da Mata Atlântica. Isso chama atenção, pois os estudos de modelagem preditiva demostram que atualmente suas áreas de ocorrência vem diminuindo devido às mudanças climáticas (INACIO-SILVA et al., 2017).
Nesse estudo, C. fragilis é a primeira ocorrência para a região Nordeste, Piauí e para a Caatinga, ampliando assim sua área de distribuição brasileira (LEFB, 2020). Esta nova citação para o estado, indica que a espécie também pode ocorrer em outras áreas adjacentes do Piauí, e no estado vizinho do Ceará que faz divisa com o Parque, distando apenas 50 km. Esses dados, de acordo com Yano e Bordin (2017) indicam a necessidade de mais estudos das briófitas com a adição e/ou intensificação de coletas em novos locais. Em especial, como afirmam Araújo et al. (2021) em outras áreas do estado do Piauí, devido a escassez de estudos, com prioridade no domínio fitogeográfico Caatinga, ampliando assim o conhecimento da distribuição geográfica desse táxon.
Já em relação a segunda espécie do gênero, C. Savannarum foi registrada para o estado do Maranhão por Costa et al. (2018) na área de Proteção Ambiental Municipal do Inhamum, em diferentes locais, crescendo na forma corticícola, epíxila e Terrícola.
Stereophyllaceae é representada por 30 espécies e oito gêneros com ampla distribuição nos trópicos (GOFFINET et al., 2009). Nesta, está inserido o gênero Entodontopsis com 16 espécies para o Neotrópico e quatro para o Brasil (GRADSTEIN et al., 2001; LEFB, 2020). Neste estudo é representado pela espécie E. leucostega.
Fissidens (65 spp.) pertence à família Fissidentaceae e apresenta-se como o segundo gênero mais diverso no Brasil e o primeiro na Caatinga com 20 espécies (COSTA; LUIZE-PONZO, 2010; LEFB, 2020). Nesse estudo, a família é representada por cinco espécies do gênero (F. intromarginatus, F. leptophyllus, F. submarginatus, F. pellucidus e F. zollingeri), sendo F. intromarginatus e F. pellucidus, as únicas não documentadas para o estado do Piauí.
Fissidens intromarginatus é amplamente distribuída no Brasil, ocorrendo em todos os biomas, exceto nos Campos Sulinos, encontrado geralmente no solo e em barrancos úmidos, mas também em rochas e raramente em troncos e base de tronco de árvore, do nível do mar a 2890m (BORDIN; YANO, 2013; BORDIN, 2015). Tem grande presença na mata, crescendo sobre tronco de árvore no Parque Nacional de Ubajara – CE (OLIVEIRA; BASTOS, 2010). Já de acordo Pursell (2008), é comumente encontrada crescendo sobre solos e rochas ao longo de córregos e raramente é encontrada colonizando troncos de árvores. Na cachoeira do Arari na ilha Marajó, Pará, a espécie foi observada crescendo apenas como terrícola (BRITO, ILKIU-BORGES, 2013).
Fissidens pellucidus apresenta uma ampla distribuição geográfica no Brasil, ocorrendo em todos os biomas, com predominância na Mata Atlântica (BORDIN; YANO, 2013). Apresenta forma de vida flabelada, ocorrendo em troncos, base de troncos e galhos de árvores, solo, rochas, sobre termiteiro e madeira em decomposição (BORDIN; YANO, 2013; BORDIN, 2015). Oliveira e Bastos (2010) encontraram a espécie ocorrendo na mata e próximo a quedas d’água, sobre solo e rochas no Parque Nacional de Ubajara – CE. Já na cachoeira do Arari, ilha Marajó, Pará, a espécie cresce apenas como corticícola (BRITO, ILKIU-BORGES, 2013).
A espécie F. pellucidus foi ainda encontrada em Mirinzal - MA, em área da Amazônia Maranhense, crescendo nos substratos corticícola e quanto ao grupo ecológico sendo uma especialista de sombra (BRITO; ILKIU-BORGES, 2014). Brito e Ilkiu-Borges (2013) encontraram a espécie crescendo apenas como corticícola em uma cachoeira na ilha do Arari em Marajó- PA, igual caso ocorrido no Povoado Pedras em São João do Sóter (VIEIRA et al., 2017).
Fissidens submarginatus é a espécie da família Fissidentaceae com a mais ampla distribuição geográfica no Brasil, presente em todos os biomas, ocorrendo preferencialmente no solo, sobre termiteiro, rochas e fendas de rochas, podendo ser encontrada também sobre troncos e base de troncos de árvores, madeira em decomposição, em barrancos, áreas abertas, degradadas ou na mata, do nível do mar até 1380 m (BORDIN; YANO, 2013; LEFB, 2020). Podendo ocorrer, ocasionalmente em raízes expostas (PURSELL, 2008). Oliveira e Bastos (2010) registraram a espécie no Parque Nacional de Ubajara, Ceará, presente na mata, crescendo sobre troncos de árvores em ambiente sombreado. Brito e Ilkiu-Borges (2013) citaram a espécie crescendo como corticícola e terrícola na cachoeira do Arari na ilha Marajó-PA. No estado do Maranhão, Costa et al. (2018) citaram F. perfalcatus crescendo na forma terrícola e epíxila na Área de Proteção Ambiental Municipal do Inhamum. Também em Caxias-MA, Oliveira et al. (2018), encontraram a espécie em área de mata fechada apresentando hábito terrícola.
Fissidens zollingeri é largamente distribuída em todo o Neotrópico, ocorrendo no Brasil em quase todos os estados (BORDIN; YANO, 2013). No Parque Nacional de Ubajara, Ceará, foi registrada por Oliveira e Bastos (2010) encontrada na mata, crescendo sobre solo em ambiente sombreado, fato também documentando por Bordin e Yano (2013). Além disso, a espécie pode ocorrer ainda sobre troncos em decomposição, ocasionalmente na base de troncos de árvores, sobre térmites e em rochas calcárias (PURSELL, 2008). Na cachoeira do Arari na ilha Marajó- PA, a espécie foi encontrada crescendo apenas como corticícola (BRITO, ILKIU-BORGES, 2013). Em Caxias-MA, a espécie pode ocorrer ainda sobre rochas, solo e como epíxilica (OLIVEIRA et al., 2018).
Splachnobryum obtusum apresenta forma de vida do tipo tufo ou folhosa, ocorrendo tipicamente em substrato do tipo rupícola ou terrícola, com distribuição moderada no território brasileiro, nos domínios fitogeográficos da Amazônia, Cerrado, Mata Atlântica e Pantanal (PERALTA et al., 2015; LEFB, 2020). No Acre foi documentada por Costa (2003) em um estudo da brioflora dos Rios Tarauacá e Juruá como sendo uma planta típica da vegetação dos rios e riachos, crescendo em solo úmido em terra firme e ao longo das margens dos rios e riachos (igarapé). Na área de Proteção Ambiental Municipal do Inhamum, Caxias - MA, a espécie foi amostrada crescendo em diferentes locais na forma Terrícola e Casmófita (COSTA et al., 2018).
A espécie S. obtusum, além de estar presente em ambiente natural, também é encontrada em ambiente antropizado, por exemplo, dentro do perímetro urbano do município de Caxias- MA. Foi citada por Silva et al. (2018), presente em um fragmento de vegetação no morro do Alecrim, sobre os substratos casmófita, rupícola e principalmente em terrícola. Santos e Lisboa (2008) descrevem que a espécie é comumente encontrada em ambientes perturbados na microrregião do Salgado Paraense pertencente a zona costeira do Pará. Já no Parque Estadual das Fontes do Ipiranga, área de Mata Atlântica na cidade de São Paulo a espécie foi encontrada exclusivamente em substratos artificiais, sendo as atividades humanas responsáveis por favorecer o seu surgimento em diferentes locais (VISNADI, 2016). Esses resultados confirmam que a espécie estar presente em diferentes tipos de substratos e ambientes (natural e antropizado).
Fossombronia porphyrorhiza foi a única representante das hepáticas presente no Parque, encontrada crescendo apenas no substrato do tipo terrícola, em ambiente sombreado e úmido, às margens de um riacho que deságua no rio Poti. De acordo com Gradstein e Costa (2003) essa espécie ocorre em solo ou rochas, em lugares abertos, frequentemente ao longo de rodovias, até 1.000 m de altitude. No município Caxias do Sul, Rio Grande do Sul, a espécie foi coletada no Parque Cinquentenário sobre paredão de rochas úmidas e em área antropizada (BORDIN; YANO, 2009). No Parque Nacional da Chapada das Mesas (PNCM) foi encontrada bem representada em vários ambientes e crescendo em diferentes tipos de substratos, como corticícola, epíxila, terrícola e rupícola, o que implica a esta espécie adaptação aos mais variados ambientes (Costa, 2017).
Nesse sentido, estudar aspectos ecológicos são importantes para fornecer informações para entender a distribuição e a ecologia das espécies de briófitas em uma área de transição ecológica no domínio da Caatinga (BATISTA et al., 2018).
Diante do número de espécies com novas ocorrências (10 spp.) para o estado do Piauí, concorda-se com Yano e Bordin (2017) que o conhecimento desta área do Parque onde as espécies foram localizadas é de extrema importância nos trabalhos florísticos e taxonômicos, para acréscimos no conhecimento da distribuição geográfica das espécies. Além disso, os autores afirmam que esses dados são de fundamental importância para os estudos de conservação, especialmente, para elaboração das listas regionais de espécies ameaçadas de extinção, às quais, entre outros critérios, levam em conta o número de localidades de ocorrência dos táxons.
3.1 Estudos da brioflora da Caatinga
A brioflora do Parque Estadual Cânion do Rio Poti, apresentam riqueza e composição de espécies de briófitas (14 spp.) abaixo dos estudos já inventariados em outros ambientes semelhantes de Caatinga no Brasil, sendo 13 musgos e uma hepática. Pesquisas anteriores de briófitas em área de Caatinga (Tabela 4), da mesma forma, encontraram maior riqueza de espécies de musgos do que hepáticas e registraram diversidades variando de 13 a 90 espécies, segundo
Pôrto et al. (1994); Pôrto e Bezerra (1996); Bastos et al. (1998); Bastos et al. (2000); Castro et al. (2002); Silva e Germano (2013); Silva et al. (2014a); Silva et al. (2014b); Silva et al. (2017a); Silva et al. (2017b); Batista et al. (2018). Sendo que o número de espécies de briófitas conhecida para a Caatinga é de 96 espécies (COSTA; PERALTA, 2015) e 125 pela lista online da flora do Brasil (2020).
Tabela 4 – Comparação dos táxons de briófitas encontrados no Parque Estadual Cânion do Rio Poti, Piauí, Brasil comum com outras listas publicadas em áreas com vegetação do domínio fitogeográfico Caatinga.
|
Táxons
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
I – Bryophyta
|
|
Campylopus fragilis (Brid.) Bruch & Schimp.
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Campylopus savannarum (Müll. Hal.) Mitt –
|
-
|
-
|
-
|
+
|
+
|
-
|
+
|
+
|
+
|
-
|
|
Dicranella hilariana (Mont.) Mitt.
|
-
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Entodontopsis leucostega (Brid.) W. R. Buck & Irelan
|
+
|
+
|
+
|
-
|
+
|
+
|
+
|
+
|
-
|
+
|
|
Fissidens intromarginatus (Hampe) Mitt.
|
-
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
-
|
-
|
|
Fissidens leptophyllus Mont.
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Fissidens pellucidus Hornsch.
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
|
Fissidens submarginatus Bruch
|
+
|
+
|
-
|
-
|
-
|
-
|
+
|
+
|
+
|
+
|
|
Fissidens zollingeri Mont.
|
-
|
-
|
-
|
-
|
+
|
|
-
|
-
|
-
|
+
|
|
Plagiobryum cellulare (Hook.) J. R. Spence & H. P. Ramsay
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Philonotis cernua (Wilson) Griffin & W. R. Buck
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
-
|
|
Philonotis uncinata (Schwägr.) Brid.
|
+
|
-
|
-
|
-
|
+
|
-
|
-
|
-
|
-
|
-
|
|
Splachnobryum obtusum (Brid.) Müll. Hal.
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
II – Hepatophyta
|
|
Fossombronia porphyrorhiza (Nees) Prosk.
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
|
Total
|
3
|
3
|
1
|
1
|
4
|
2
|
4
|
3
|
2
|
5
|
|
|
|
|
|
|
|
|
|
|
|
Fonte. Dados do autor com consulta na Lista online de espécies da Flora do Brasil 2020 (2021), disponível em: http://floradobrasil.jbrj.gov.br/reflora/floradobrasil/. Acesso em: 25/05/2021.
Legenda: 1. (PÔRTO et al., 1994). 2. (PÔRTO; BEZERRA, 1996). 3. (BASTOS et al., 1998). 4. (BASTOS et al., 2000). 5. (CASTRO et al., 2002) 6. (SILVA; GERMANO, 2013). 7. (SILVA et al., 2014a). 8. (SILVA et al., 2014b). 9. (SILVA et al, 2017a). 10. (BATISTA et al., 2018). (+) presença e (-) ausência das espécies das listas publicadas comuns a esse estudo.
As principais pesquisas com briófitas realizadas no bioma Caatinga demostraram uma maior diversidade, quando comparados com esta pesquisa (tabela 5).
Tabela 5 – Comparação entre a diversidade de briófitas em diferentes áreas de Caatinga no Brasil.
|
Autor
|
Localidade
|
Número de espécies
|
|
Este estudo
|
Parque Estadual cânion do rio Poti
|
14
|
|
Pôrto et al. (1994).
|
Estação Experimental da Empresa Pernambucana de Pesquisas Agropecuárias (IPA), Caruaru – PE.
|
16
|
|
Pôrto e Bezerra (1996).
|
Em área de Caatinga do município de Agrestina - PE
|
13
|
|
Bastos et al. (1998b).
|
Em 10 diferentes áreas da Caatinga no estado da Bahia
|
18
|
|
Bastos et al. (2000).
|
EM área de campos rupestres da Chapada Diamantina – BA
|
65
|
|
Silva e Germano (2013).
|
Em dois afloramentos rochosos no município de Puxinanã, na região do Agreste do estado da Paraíba, Brasil
|
21
|
|
Silva et al. (2014a).
|
Em sete afloramentos rochosos situados na região semiárida do Estado de Pernambuco
|
49
|
|
Silva et al. (2014b).
|
Em dezoito afloramentos rochosos nos estados da Paraíba, Pernambuco e Bahia
|
90
|
|
Silva et al. (2017a).
|
Em quatro afloramentos rochosos em florestas secas brasileiras (Caatinga) nos estados da Paraíba e Pernambuco
|
19
|
|
Batista et al. (2018).
|
Enclave de floresta úmida da Chapada do Araripe - PE
|
76
|
Fonte. Elaborado pelo autor, agosto de 2021.
Pelo exposto, nota-se que as citações referentes a briófitas ocorrentes em algumas áreas de semiárido (Caatinga) são reduzidas, ou seja, é uma área pouco estudada. De acordo com Costa e Peralta (2015) este é o domínio fitogeográfico que apresenta a menor diversidade de briófitas do país. Segundo Pôrto e Bezerra (1996), os principais fatores responsáveis por esse número reduzido de espécies, é devido o número reduzido de coletas realizadas nestes ambientes ou a real escassez destas plantas, que quase sem nenhuma defesa, possuem à dessecação em ambientes semiáridos, tornando-se assim resistentes, de ciclo de vida curto ou revivescestes.
Quando se compara os dados da lista de briófitas desse estudo com as listagens de espécies de estudos similares em áreas de Caatinga, percebe-se que algumas delas se faz presente em uma maior quantidade de pesquisas, como é o caso da espécie E. leucostega. Essa espécie é bem amostrada nos estudos em áreas de Caatinga no Nordeste (PÔRTO et al., 1994; PÔRTO e BEZERRA, 1996; BASTOS et al., 1998; CASTRO et al., 2002; SILVA e GERMANO, 2013; SILVA et al., 2014a; SILVA et al., 2014b; SILVA et al., 2017a; BATISTA et al., 2018).
A espécie C. savannarum foi amostrada na composição florística em algumas áreas da Caatinga (BASTOS et al., 2000; CASTRO et al., 2002; SILVA et al., 2014a; SILVA et al., 2014b; SILVA et al., 2017). Assim como a espécie F. submarginatus (PÔRTO, et al., 1994; PÔRTO e BEZERRA, 1996; SILVA et al., 2014a; SILVA et al., 2014b; SILVA et al., 2017; BATISTA et al., 2018).
Além dessas, outras espécies de briófitas também são citadas nessa pesquisa apresentando ocorrência comum em áreas de Caatinga a D. hilariana (Pôrto; Bezerra, 1996), F. intromarginatus (Silva; Germano, 2013), F. pellucidus (Batista et al., 2018), F. zollingeri (Castro et al., 2002; Batista et al., 2018), F. porphyrorhiza (Batista et al., 2018), P. cernua (Silva et al., 2014a), P. uncinata (Pôrto, et al., 1994; Castro et al., 2002). Já as espécies B. cellulare, C. fragilis, F. leptophyllus e S. obtusum não ocorrem comumente em áreas do bioma Caatinga.
É importante destacar que a bryoflora da caatinga é composta por várias espécies restritas a esse tipo de vegetação, principalmente, as generalistas e os táxons xerofílicos, podendo ainda ser encontradas algumas espécies higrófilas (BASTOS et al., 1998b). Para Bastos et al. (1998b), as espécies presente no bioma Caatinga aparece muito pobre devido à extrema secura do clima, quando comparado com outros tipos de vegetação brasileira. Para os autores, não é fácil encontrar briófitas em áreas abertas, nesse domínio fitogeográfico, uma vez que, a maioria delas se refugiam em micro-habitats onde a secura é mitigada. Isso ocorre devido os ambientes tropicais, e às comunidades de briófitas estabelecidas apresentarem características ecofisiológicas de adaptação à tolerância às altas temperaturas, à alta radiação luminosa e à dessecação (PROCTOR, 1982; WAGNER et al., 2014). Além disso, nesses ambientes influenciados por regime hídrico sazonal ou inconstante, os táxons que apresentam menor tolerância à dessecação, acaba sendo selecionado ou excluído, por ação natural do processo de especialização (WAGNER et al., 2014). Esses são fatores chaves que contribuem para que apenas poucas espécies de briófitas estejam presentes em algumas áreas da Caatinga, como a pouca ocorrência nesta pesquisa (14 spp.).
A Caatinga, assim como as áreas de afloramentos rochosos de toda a região do Parque Estadual Cânion do Rio Poti, propicia uma variedade de micro-habitats, tais como todo o trecho de afloramento do Cânion do Rio Poti, que abrigam uma flora briofítica especializada e pouco diversificada devido às suas peculiares condições físico-climáticas, com períodos de alta umidade atmosférica e relevo característico.
Atualmente, novas áreas no bioma Caatinga com enfoque na abrangência territorial das briófitas estão sendo contempladas em estudos, tanto nos aspectos florístico-taxonômicos como biogeográficos (BÔAS-BASTOS; BASTOS, 2016). No entanto, a respeito dessa constatação, Costa e Peralta (2015) afirma que é necessário a realização de novos estudos e pesquisas para esclarecer e preencher importantes lacunas reconhecidas e relacionadas ao número e circunscrição das espécies, bem como quanto à taxonomia e a distribuição geográfica dos taxa, principalmente em regiões que precisam de maiores esforços de coleta e que permanecem insuficientemente amostradas. Assim, com o prosseguimento das coletas em novas áreas no bioma Caatinga, como esse estudo, há a perspectiva de novos registros, em especial de outras espécies, possibilitando a abrangência da distribuição geográfica para outros estados brasileiros (NASCIMENTO et al., 2019; SILVA et al., 2019; SOUSA et al., 2019a,b; NASCIMENTO et al., 2020; ARAÚJO et al., 2021).
Os dados sobre a riqueza e abundancia das espécies de Briófitas (14 spp.) presentes no Parque, refletem sobre a importância e a necessidade de conservação permanente do mesmo. Assim, os resultados apresentados nesse estudo, corroboram para ampliar a distribuição geográficas das espécies para a brioflora do estado, bem como para demonstrar a flora do grupo presente no Parque Estadual Cânion do Rio Poti, contribuindo para estudos futuros de conservação ambiental. Assim, percebe-se a importância dos levantamentos florístico, em especial das briófitas no estado do Piauí, pois estes contribuem com o conhecimento da distribuição geográfica das espécies de briófitas ocorrentes no Brasil (COSTA; PERALTA, 2015; PÔRTO et al., 2016; PENALOZA-BOJACÁ et al., 2017a; SILVA et al., 2019).
4 CONSIDERAÇÕES FINAIS
Esses números (14 spp.) apresentados nessa pesquisa, representam uma atualização no conhecimento desse grupo para o Estado do Piauí, pois é a oitava listagem florística de briófitas e vem preencher uma lacuna relacionada a número, circunscrição de espécies e o padrão de distribuição geográfica brasileira dos taxa. Firma-se a isso, a necessidade de maiores esforços de coleta, tanto na área de delimitação do Parque, no Município de Buriti dos Montes e em outros municípios limítrofes (enquadrados em várias fitofisionomias), a fim de ampliar o conhecimento da brioflora que permanece insuficientemente amostrada na região.
Notoriamente, o estudo da brioflora no Parque não se dar por finalizado ou suficiente, uma vez que outras espécies já citadas para o Estado (50 spp.) e (37 spp. na vegetação de Caatinga do Piauí podem ser acrescentadas para fazer parte na composição da vegetação, pois apenas um trecho do médio Cânion do Rio Poti, em áreas de afloramentos rochosos, foi explorado e amostrado. Logo, se faz necessário, a ampliação das áreas de coletas para outras fitofisionomias em ambientes diferenciados (lagos, lagoas, riachos, morros e serras) dentro e no entorno da área de delimitação do Parque.
Por fim, esse estudo florístico, além de contribuir para a ampliação da área de distribuição geográfica das espécies do Parque para estado do Piauí e a Caatinga, vem destacar a importância desse e de futuros inventários florísticos na UC e nas áreas adjacentes como auxiliadores da preservação permanente dessas áreas, fornecendo subsídios para a conservação permanente da flora da região, em especial a do Parque.
AGRADECIMENTOS
Ao Programa de Pós-Graduação em Biodiversidade, Saúde e Meio Ambiente/ PPGBAS, do Centro de Estudos Superiores de Caxias / CESC, da Universidade Estadual do Maranhão/UEMA. À Fundação de Amparo à Pesquisa e ao Desenvolvimento Científico e Tecnológico do Maranhão - FAPEMA, pela concessão da bolsa de estudo de mestrado e apoio financeiro na pesquisa ao primeiro autor. Aos amigos: Regigláucia Rodrigues Oliveira (Doutoranda em Desenvolvimento e Meio Ambiente, da Universidade de Federal do Piauí - UFPI) e Hermeson Cassiano de Oliveira (Professor Dr. da Universidade Estadual do Piauí – UESPI) pelas identificações e confirmações das espécies.
REFERÊNCIAS
ARAUJO, J.; OLIVEIRA, H. C.; ALVES, M. H. Briófitas ocorrentes no parque ecológico Cachoeira do Urubu, Esperantina-Piauí, Brasil. Tópicos Integrados em Botânica. 1ed.: Atena Editora, 2021, v. 1, p. 59-74.
BALLEJOS, J.; BASTOS, C. J. P. Musgos Pleurocárpicos do Parque Estadual das Sete Passagens. Hoehnea, v. 36, n. 3, p.479-495, 2009.
BARRETO, L. L.; COSTA, L. R. F.; CLAUDINO-SALES, V. C. Cânion do rio Poti: contribuição para a geomorfologia estrutural do oeste cearense. In: AGUIAR, P. F.; MEIRELES, A. J. A. (Orgs.). Relevo cearense: perspectivas de análises. Porto Alegre: Liro, 2012.
BARRETO, L. L.; COSTA, L. R. F. Evolução geomorfológica e condicionantes Morfoestruturais do cânion do Rio Poti, nordeste do Brasil. Revista Brasileira de Geomorfologia, São Paulo, v.15, n.3, p. 411-424, 2014.
BASTOS, C. J. P.; STRADMANN, M. T. S.; BÔAS-BASTOS, S. B. V. Additional contribution to the bryophyte flora of Chapada Diamantina National Park, state of Bahia, Brazil. Tropical Bryology, v. 15, n. 1, p. 15-20, 1998a.
BASTOS, C. J. P.; ALBERTOS, B.; VILAS-BÔAS, S. B. Bryophytes from some ‘caatinga’ areas in the state of Bahia (Brazil). Tropical Bryology, v.14, p. 69-75, 1998b.
BASTOS, C. J. P.; YANO, O.; BÔAS- BASTOS , S. B. V. Briófitas de campos rupestres da Chapada Diamantina, Estado da Bahia, Brasil. Revista Brasil. Bot., São Paulo, v.23, n.4, p. 359-370, 2000.
BATISTA, W. V. S. M.; SANTOS, N. D. Can regional and local fi lters explain epiphytic bryophyte distributions in the Atlantic Forest of southeastern Brazil? Acta Botanica Brasilica, v. 30, n. 3, p. 462-472. 2016.
BATISTA, W. V. S. M.; PÔRTO, K. C.; SANTOS, N. D. Distribution, ecology, and reproduction of bryophytes in a humid enclave in the semiarid region of northeastern Brazil. Acta Botanica Brasilica, v. 32, n. 2, p. 303-313, 2018.
BRITO, E. S.; ILKIU-BORGES, A. L. Bryoflora of the municipalities of Soure and Cachoeira do Arari, on Marajó Island, in the state of Pará, Brazil. Acta Botânica Brasílica, v. 27, v. 1, p.124-141, 2013.
BRITO, E. S.; ILKIU-BORGES, A. L. Briófitas de uma área de Terra Firme no município de Mirinzal e novas ocorrências para o estado do Maranhão, Brasil. Iheringia, Série Botânica, v. 69, n. 1, p. 133-142, 2014.
BÔAS-BASTOS, S. B. V.; BASTOS, C. J. P. Duas novas ocorrências de hepáticas folhosas (Marchantiophyta) para o estado da Bahia, Brasil. Rodriguésia, v. 67, n. 4, p. 1101-1106, 2016.
BORDIN, J. Briófitas do centro urbano de Caxias do Sul, Rio Grande do Sul, Brasil. 2008. 112 p. Dissertação de Mestrado. Instituto de Botânica, São Paulo. 2008.
BORDIN, J.; YANO, O. Novas ocorrências de antóceros e hepáticas para o Estado do Rio Grande do Sul, Brasil. Revista Brasil Bot, v.32, n.2, p.189-211, 2009.
BORDIN, J.; YANO, O. Fissidentaceae (Bryophyta) do Brasil. Boletim do Instituto de Botânica, 2013.
BORDIN, J. Fissidentaceae. in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. 2015. Disponivel em: http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/FB96335. Acesso em: 06 de novembro de 2018.
BUCK, W. R. Guide to the Plants of Central French Guiana. Part 3. Mosses. Memoirs of The New York Botanical Garden, v. 76, p. 1-167, 2003.
BUCK, W. R.; GOFFINET, B. Morphology and Classification of Mosses. In: SHAW, A. J.; GOFFINET, B. (eds.). Bryophyte Biology. New York: Cambridge University Press, p. 55-138, 2009.
CASTRO, N. M. C. F.; PÔRTO, K. C.; YANO, O. CASTRO, A. A. J. F. Levantamento florístico de bryopsida de cerrado e mata ripícola do Parque Nacional de Sete Cidades, Piauí, Brasil. Acta bot. bras, v. 16, n. 1, p. 61-76, 2002.
CEPRO. Diagnóstico das condições ambientais de Estado do Piauí, Teresina, 1995.
COSTA, A. M. R.; OLIVEIRA, R. R.; SÁ, N. A. S.; CONCEIÇÃO, G. M. Briófitas do Cerrado Maranhense, Nordeste do Brasil. Revista NBC, Belo Horizonte, v. 8, n. 16, p. 3-45, 2018.
COSTA, D. P. Florisitic composition and diversity of Amazonian rainforest bryophytes in the state of Acre, Brazil. Acta Amazonica, v. 33, n. 3, p. 399-414, 2003.
COSTA, L. R. F.; MAIA, R. P.; BARRETO, L. L.; CLAUDINO-SALES, V. C. Geomorfologia do nordeste setentrional brasileiro: uma proposta de classificação. Revista brasileira de geomorfologia, v. 21, p. 185-208, 2020. DOI: http://dx.doi.org/10.20502/rbg.v21i1.1447
COSTA, D. P. Musgos do Pico da Caledônea, município de Nova Friburgo, estado do Rio de Janeiro, Brasil. Acta Botanica Brasilica, v. 8, n. 2, p. 141-191, 1994.
COSTA, D. P.; LUIZI-PONZO, A. P. Introdução as Briófitas do Brasil. Instituto de Pesquisas Jardim Botânico do Rio de Janeiro. Catálogo de Plantas e Fungos do Brasil. v.1, p. 61-68, 2010.
COSTA, D. P.; PERALTA, D. F. Briófitas in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em: http://reflora.jbrj.gov.br/jabot/floradobrasil/FB128472. Acesso em: 20 de junho de 2020.
COSTA, D. P.; PERALTA, D. F. Bryophytes diversity in Brazil. Rodriguésia, v. 66, n.4, p. 1063-1071, 2015.
COSTA, F. B. Hepáticas (Marchantiophyta) do Parque Nacional Chapadas das Mesas, Maranhão, Brasil. 2017. 100 p. Dissertação (Mestrado) – Centro de Estudos Superiores de Caxias, curso de Pós-Graduação em Biodiversidade, Ambiente e Saúde. 2017.
CRANDALL-STOTLER, B.; STOTLER, R.E.; LONG, D.G. Morphology and classification of Marchantiophyta. In: Bryophyte Biology. GOFFINET, B.; SHAW, A. J. (eds.). Cambridge University Press, Cambridge, p. 1-54, 2009.
FORZZA, R. C. et al. Introdução. In: FORZZA, R. C. et al. (eds.). Lista de espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. v.1. Rio de Janeiro, Jardim Botânico do Rio de Janeiro. 2010.
FRAHM, J. P. Dicranaceae: Campylopodioideae, Paraleucobryoideae. Flora Neotropica, v. 54, p. 1-236, 1991.
FRAHM, J. P. Biologie der Moose. Heidelberg/Berlin, Spektrum Akademischer Verlag. 2001.
FRAHM, J. P. Manual of tropical Bryology. Tropical Bryology, v. 23, p. 1-196, 2003.
GÓES, A. M. O.; SOUZA, J. M. P; TEIXEIRA, L. B. Estagio exploratório e perspectivas petrolíferas da bacia do Parnaíba. Boletim de Geociências da Petrobrás, v. 4, p. 55-64, 1995.
GOFFINET, B.; BUCK, W. R.; SHAW, A. J. Morphology and Classification of the Bryophyta. In: Goffinet, B.; Shaw, A. J. (eds.). Bryophyte Biology. New York: Cambridge University Press, p. 55-138, 2009.
GRADSTEIN, S. R.; CHURCHILL, S. P.; SALAZAR-ALLEN, N. Guide to the Bryophytes of Tropical America. Memoirs of the New York Botanical Garden, v. 86, 577p, 2001.
GRADSTEIN, S. R.; COSTA, D. P. The Hepaticae and Anthocerotae of Brazil. Memoirs of The New York Botanical Garden, v. 87, p. 1-318, 2003.
INÁCIO-SILVA, M.; CARMO, D. M.; PERALTA, D. F. As espécies brasileiras endêmicas de Campylopus Brid. (Bryophyta) estão ameaçadas? Uma análise usando modelagem para avaliar os seus estados de conservação. Hoehnea, v. 44, n. 3, p. 464-472, 2017.
IUCN, Standards and Petitions Committee. Guidelines for using the IUCN Red List categories and criteria. Version 14. Prepared by the Standards and Petitions Committee. 2019. Disponível em: http://www.iucnredlist.org/documents/RedListGuidelines.pdf. Acesso em: 20 nov. 2020.
IUCN. 2020. Lista vermelha de espécies ameaçadas da IUCN. Versão 2020-2. Disponível em: <https://www.iucnredlist.org>. Acesso em: 13/05.2021.
IUCN. Standards and Petitions Subcommittee. Guidelines for Using the IUCN Red List Categories and Criteria. Version 10. Prepared by the Standards and Petitions Subcommittee. 2013. Disponível em: http://jr.iucnredlist.org/documents/RedListGuidelines.pdf. Acesso em: 20 de novembro de 2019.
LEMOS-MICHEL, E. Hepáticas Epífitas sobre o pinheiro-brasileiro no Rio Grande do Sul. Editora da Universidade, Porto Alegre, 2001. 191p.
LEFB. Lista de Espécies da Flora do Brasil (LEFB). 2020. Disponível em: floradobrasil.jbrj.gov.br. Acesso em: 10 de junho de 2021.
MACEDO, L. P. C.; ILKIU-BORGES, A. L. Richness of Marchantiophyta and Bryophyta in a protected area of the Brazilian Amazon. Acta Bot. Bras, v. 28, n. 4, p. 527-538, 2014.
MORAES, L. A., ARAÚJO, M. F. V., CONCEIÇÃO, G. M. Levantamento florístico das angiospermas do Parque Estadual Cânion do rio Poti, Buriti dos Montes – PI. Revista Brasileira de Geografia Física, v. 14, n. 4, p. 1987-2014, 2021. DOI: 10.26848/rbgf.v14.4.p1987-2014.
MORAES, L. A.; ARAUJO, M. F. V.; CONCEICAO, G. M. O processo de criação e implantação do Parque Estadual Cânion rio Poti, Buriti dos Montes, Piauí. Research, society and development, v. 9, p. e71996486, 2020. DOI: https://doi.org/10.33448/rsd-v9i9.6486.
MORAES, L. A.; ARAUJO, M. F. V.; CONCEICAO, G. M. Samambaias do Parque estadual Cânion do rio Poti, Buriti dos Montes, Piauí. Revista de ciências ambientais, v. 15, p. 1-20, 2021. DOI: http://dx.doi.org/10.18316/rca.v15i1.7050.
MORI, S. A.; SILVA, L. A. M.; LISBOA, G.; CORANDIN, L. Manual de manejo do herbário fanerogâmico. 2 ed. Ilhéus: Centro de Pesquisas do Cacau. 1989. 103 p.
NASCIMENTO, G. M. G., CONCEIÇÃO, G. M., PERALTA, D. F., OLIVEIRA, H. C. Bryophytes of Sete Cidades National Park, Piauí, Brazil. Check List, v. 16, n. 4, p. 969-988, 2020. DOI: https://doi.org/10.15560/16.4.969
NASCIMENTO, G. M. G.; CONCEIÇÃO, G. M.; PERALTA, D. F.; OLIVEIRA, H. C. Bryophytes of Serra da Capivara National Park, Piauí, Brazil. Check List, v. 15, n. 5, p. 833-845, 2019. DOI: https://doi.org/10.15560/15.5.833
OLIVEIRA, H. C.; BASTOS, C. J. P. Musgos pleurocárpicos da Chapada da Ibiapaba, Ceará, Brasil. Acta Botanica Brasilica, v. 24, n. 1, p. 193-204, 2010a.
OLIVEIRA, H. C.; BASTOS, C. J. P. Fissidentaceae (Bryophyta) da Chapada da Ibiapaba, Ceará, Brasil. Revista Brasileira de Botânica, v. 33, p. 393-405, 2010b.
OLIVEIRA, R. R. Musgos (Bryophyta) do Parque Nacional da Chapada das Mesas, Maranhão, Brasil. 2017. 148p. Dissertação (Mestrado) – Centro de Estudos Superiores de Caxias, curso de Pós-Graduação em Biodiversidade, Ambiente e Saúde. 2017.
OLIVEIRA, R. F.; SILVA, G. S.; OLIVEIRA, R. R.; OLIVEIRA, H. C.; CONCEIÇÃO, G. M. Musgos (Bryophyta) de um fragmento do cerrado maranhense, Brasil. Biota Amazônica, v. 8, n. 2, p. 12-18, 2018.
PEÑALOZA-BOJACÁ, G. F.; OLIVEIRA, B. A.; ARAÚJO, C. A. T.; FANTECELLE, L. B.; MACIEL-SILVA, A. S. Bryophyte reproduction on ironstone outcrops: delicate plants in harsh environments. Flora (in press), 155-161, 2017.
PERALTA, D. F. Musgos (Bryophyta) do Parque Estadual da Ilha Anchieta (PEIA) São Paulo, Brasil. 2005. 227p. Dissertação de mestrado, Instituto de Botânica, São Paulo. 2005.
PERALTA, D. F.; SILVA, A. L.; CARMO, D. M.; SANTOS, E. L. D.; LIMA, J. S.; AMELIO, L. A.; SILVA, M. S. D.; PRUDÊNCIO, R. X. A. Splachnobryaceae, In: Flora do Brasil 2020 em construção. Jardim Botânico do Rio de Janeiro. 2020. Disponível em: http://floradobrasil.jbrj.gov.br/reflora/floradobrasil/FB97113. Acesso em: 06 Nov. 2018.
POREMBSKI, S. Tropical inselbergs: habitat types, adaptative strategies and diversity patterns. Revista Brasileira de Botânica, v. 30, n. 4, p. 579-586, 2007.
PÔRTO, K. C.; SILVEIRA, M. F. G.; ALMEIDA, P. S. Briófitas da Caatinga: estação experimental do Ipa, Caruaru – PE. Acta boI. Bras, v. 8, n. 1, p. 77-85, 1994.
PÔRTO, K. C.; BEZERRA, M. F. A. Briófitas de caatinga. 2. Agrestina, pernambuco, brasil. Acta bot. bras, v. 10, n. 1, p. 93-102, 1996.
PÔRTO, K. C.; SILVA, I. C. C.; REIS, L. C.; MACIEL-SILVA, A. S. Sex ratios and sporophyte production in the moss Bryum argenteum Hedw. on a rock outcrop, north-eastern Brazil. J. Bryol, p. 1-5, 2016.
PROCTOR, M. C. F. Chapter 10: Physiological Ecology: Water relations, light and temperature responses, carbon balance. In: A.J.E. Smith (ed.). Bryophyte Ecology. 2 ed. Chapman and Hall, New York, p. 333-382, 1982.
PROCTOR, M. C. F.; OLIVER, M. J.; WOOD, A. J.; ALPERT, P.; STARK, L.; CLEAVITT, N.; MISHLER, B. Desiccation-tolerance in bryophytes: a review Desiccation-tolerance. In: bryophytes: a review. The American Bryological and Lichenological Society, v. 110, 595-621, 2007.
PURSELL, R. A. Fissidentaceae: Flora Neotropica Monograph, v. 101, p. 1-278, 2008.
RAMSAY, H. P.; BERRIE, G. K. Sex determination in bryophytes. J. Hattori Bot. Lab. 52, p. 255-274, 1982.
SANTOS, R. C. P.; LISBOA, R. C. L. Musgos (bryophyta) da microrregião do Salgado Paraense e sua utilização como possíveis indicadores de ambientes perturbados. Rodriguésia, v. 59, n. 2, p. 361-368, 2008.
SANTOS, J. C. V.; OLIVEIRS, H. C.; ALVES, M. H. Estudo das briófitas do Bosque Sagrado da Guarita, Bom Princípio do Piauí, Piauí, Brasil. Research, Society and Development, v. 10, n. 5, 2021. DOI: http://dx.doi.org/10.33448/rsd-v10i5.13433.
SHAW, A. J.; GOFFINET, B. Bryophyte Biology. Cambridge, New York, Melbourne, Madrid, Cape Town, Singapore, São Paulo, 2. ed., 2009.
SILVA, J. B.; GERMANO, S. R. Bryophytes on rocky outcrops in the caatinga biome: a conservationist perspective. Acta Botanica Brasilica, v. 27, n. 4, p. 827-35, 2013.
SILVA, J. B.; SILVA, M. P. P.; PÔRTO, K. C. Briófitas de afloramentos rochosos do Estado de Pernambuco, Brasil. Boletim do Museu de Biologia Mello Leitão, v. 36, p. 85-100, 2014a.
SILVA, J. B.; SANTOS, N. D.; PÔRTO, K. C. Betadiversity: effect of geographical distance and environmental gradients on the rocky outcrop bryophytes. Cryptogamie, Bryologie, v.35, p. 133-63, 2014b.
SILVA, J. B.; PÔRTO, K. C. Can we use the acrocarpous moss gametophyte length to assess microclimatic conditions in harsh environmental? Frahmia, v.12, p. 1-9, 2016.
SILVA, J. B. et al. Bryophyte richness of soil islands on rocky outcrops is not driven by island size or habitat heterogeneity. Acta Botanica Brasilica, v. 32, n. 2, p. 161-168, 2018a.
SILVA, H. V. M., AQUINO, C. M. S., AQUINO, R. P. 2021. Geoconservação no geomorfossítio Complexo Mini Cânion do Rio Poti, Juazeiro do Piauí, Piauí, Brasil. Revista do departamento de Geografia. v. 4, e170107. DOI:10.11606/eISSN.2236-2878.rdg.2021.170107.
SILVA, J. B.; et al. Different trait arrangements can blur the significance of ecological drivers of community assembly of mosses from rocky outcrops. Flora, v. 238, p. 43-50, 2018b.
SILVA, A. M.; OLIVEIRA, R. R.; CONCEIÇÃO, G. M. Musgos (Bryophyta) do Morro do Alecrim, centro urbano de Caxias, Maranhão, Brasil. Rev. Arq. Científicos (IMMES). v. 1, n. 1, p. 55-62, 2018.
SILVA, A. C. R.; OLIVEIRSA, H. C.; CONCEICAO, G. M. Brioflora do estado do Piauí: novos registros para a caatinga e cerrado. Enciclopédia biosfera, v.16, n.29; p. 1809-1820, 2019. DOI: 10.18677/EnciBio_2019A139
SOUSA, M. E. B. D.; ABREU, G. M. C. D; GOMES, M. S. G.; OLIVEIRA, H. C. D. Diversidade de briófitas da cachoeira do Bota-fora, Piripiri, Piauí, Brasil. In: André Luiz Oliveira de Francisco. (Org.). Botânica aplicada 2. 1ed. Belo Horizonte: 2019b, v. 2, p. 189-198.
SOUSA, M. E. B.; OLIVEIRA, H. C. Briófitas de uma área ecotonal de Caatinga/Cerrado no estado do Piauí, Brasil. Enciclopédia Biosfera, v.16 n.29, P. 1796-1808, 2019. DOI: 10.18677/EnciBio_2019A138.
VALENTE, E. B.; PÔRTO, K. C. Briófitas de uma área de afloramento rochoso na Serra da Jibóia, município de Santa Teresinha, Bahia, Brasil. Boletim do Instituto de Botânica, v.18, p. 207-11, 2006a.
VALENTE, E. B.; PÔRTO, K. C. Hepáticas (Marchantiophyta) de um fragmento de Mata Atlântica na Serra da Jibóia, município de Santa Teresinha, BA, Brasil. Acta Botanica Brasilica, v. 20, p. 433-441, 2006b.
VALENTE, E. B.; PÔRTO, K. C.; BASTOS, C. J. P. Species richness and distribution of bryophytes within different phytophysiognomies in the Chapada Diamantina region of Brazil. Acta Botanica Brasilica, v. 27, n. 2, p. 294-310, 2013.
VANDERPOORTEN, A.; GOFFINET, B. Introduction of Bryophytes. Cambridge University Press, 2009. 294p.
VIANA, P. L. et al. Flora of the cangas of the Serra dos Carajás Pará, Brazil: history, study area and methodology. Rodriguésia, v. 67, p. 1107-1124, 2016.
VIEIRA, H. C. A.; OLIVEIRA, R. R.; SILVA, M. L. A.; SILVA, D. L. S.; CONCEIÇÃO, G. M.; OLIVEIRA, H. C. Briófitas de ocorrências em São João do Sóter, Maranhão, Brasil. Acta Brasiliensis, v. 1, n. 2, p. 8-12, 2017.
VISNADI, S. R. Parque Estadual das Fontes do Ipiranga: unidade de conservação importante para a proteção da brioflora da Mata Atlântica na cidade de São Paulo, Brasil. Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais, v. 3, n. 10, p. 437-469, 2016.
WAGNER, S.; BADER, M. Y.; ZOTZ, G. Physiological Ecology of Tropical Bryophytes. In: HANSON, D. T.; RICE, S. K. (eds.). Photosynthesis in Bryophytes and Early Land Plants. Springer, New York, p. 269-290, 2014.
YANO, O.; J. BORDIN. Ampliação do conhecimento sobre a distribuição geográfica de espécies de briófitas no Brasil. Bol. Soc. Argent. Bot., v. 52, n. 2, p. 383-392, 2017.
Contribuições de Autoria
1 - Lorran André Moraes,
Doutorando no Programa de Pós-graduação em Desenvolvimento e Meio Ambiente, Universidade Federal do Piauí (UFPI). Mestre em Biodiversidade, Ambiente e Saúde, Universidade Estadual do Maranhão (UEMA). Professor substituto da Universidade Estadual do Maranhão (UEMA), Coelho Neto -MA.
https://orcid.org/0000-0002-3858-3059 - lorranbio@hotmail.com
Contribuição: Escrita – Primeira Redação
2 - Maria de Fátima Veras Araújo
Doutora em Geografia, Professora do curso de Ciências Biológicas, Universidade Estadual do Piauí (UESPI).
http://orcid.org/0000-0002-1653-8476 - maria.fveras2018@gmail.com
Contribuição: supervisão e revisão do texto
3 - Gonçalo Mendes da Conceição
Doutor em Zootecnia, Professor do curso de Ciências Biológicas, Universidade Estadual do Maranhão (UEMA).
http://orcid.org/0000-0001-9056-9070 - doutorgoncalo@gmail.com
Contribuição: Escrita, supervisão e revisão do texto
Como citar este artigo
MORAES, L., A.; ARAÚJO, M. F. V.; CONCEIÇÃO, G. M. Brioflorula (bryophyta\musgos e marchantiophyta\hepáticas) do Parque Estadual Cânion do rio Poti, Buriti dos Montes – PI Geografia Ensino & Pesquisa, Santa Maria, v. 25, e28, p. 1-42, 2021. DOI 10.5902/2236499447876. Disponível em: https://doi.org/10.5902/2236499447876. Acesso em: dia mês abreviado. ano.